道尔顿分压定律
编辑道尔顿分压法指出,在非反应性气体的混合物中,施加的总压力等于各个气体分压的总和。
公式
编辑在数学上,非反应性气体混合物的压力可以定义为总和: p total = ∑ i = 1 n p i = p 1 + p 2 + p 3 + ⋯ + p n
其中 xi 是第 i 个组分在 n 个组分的总混合物中的摩尔分数。
基于体积的浓度
编辑下面的关系提供了一种方法来确定任何单个气体成分的基于体积的浓度 p i = p total c i 其中 ci 是 组分 i 的浓度。
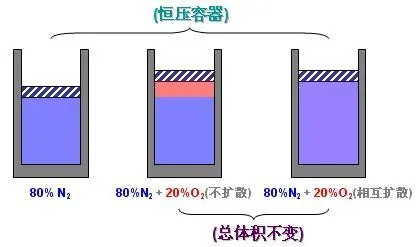
真实气体并不严格遵循道尔顿分压规定,偏差随压力增加而增加。 在这种情况下,与分子之间的自由空间相比,分子占据的体积变得很大。 特别是,分子间较短的平均距离增加了气体分子间的分子间作用力,足以显着改变它们施加的压力,理想气体模型中不包括这种效应。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214213/
