阿伏伽德罗定律
编辑阿伏伽德罗定律(有时称为阿伏伽德罗假说或阿伏伽德罗原理)或阿伏伽德罗-安培假说是一种实验气体定律,将气体的体积与存在的气体物质的量联系起来 . 该定律是理想气体定律的一个特例。 现代说法是:
阿伏伽德罗定律指出,在相同的温度和压力下,等体积的所有气体具有相同数量的分子。
对于给定质量的理想气体,如果温度和压力恒定,则气体的体积和数量(摩尔数)成正比。
例如,等体积的气态氢气和氮气在相同温度和压力下包含相同数量的原子,并观察理想气体行为。 在实践中,真实气体与理想行为有很小的偏差,该定律仅近似成立,但对科学家来说仍然是一个有用的近似值。
数学定义
编辑V是气体的体积;
- n 是气体物质的量(以摩尔为单位);
- 对于给定的温度和压力,k 是一个常数。
该定律描述了在相同的温度和压力条件下,等体积的所有气体如何包含相同数量的分子。 为了在两组不同的条件下比较相同的物质,
该方程表明,随着气体摩尔数的增加,气体的体积也按比例增加。 同样,如果气体的摩尔数减少,则体积也会减少。 因此,特定体积的理想气体中分子或原子的数量与其大小或气体的摩尔质量无关。
理想气体定律的推导
编辑阿伏伽德罗定律的推导直接遵循理想气体定律
其中 R 是气体常数,T 是开尔文温度,P 是压力(以帕斯卡为单位)。
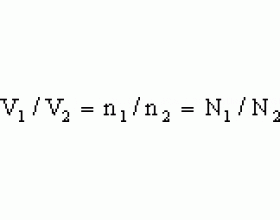
对于固定压力和固定温度,这是一个常数。
理想气体定律的等效公式可以使用玻尔兹曼常数 kB 写成,
其中 N 是气体中的粒子数,R 与 kB 之比等于阿伏加德罗常数。
如果 T 和 P 在标准温度和压力条件 (STP) 下获取,则 k′ = 1/n0,其中 n0 是 Loschmidt 常数。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/216098/
