放热反应
编辑在热化学中,放热反应是总标准焓变 ΔH⚬ 为负的反应。 放热反应通常会释放热量。 该术语经常与放能反应混淆,IUPAC 将其定义为……整体标准吉布斯能量变化 ΔG⚬ 为负的反应。 强烈放热反应通常也是放能反应,因为 ΔH⚬ 对 ΔG⚬ 有很大贡献。 课堂上演示的大多数壮观的化学反应都是放热和放能的。 相反的是吸热反应,它通常吸收热量并由系统中的熵增加驱动。
例子
编辑这些样品反应强烈放热。
不受控制的放热反应会导致火灾和爆炸,这是一种浪费,因为很难捕获释放的能量。 大自然在高度受控的条件下影响燃烧反应,避免火灾和爆炸,在有氧呼吸中捕获释放的能量,例如 用于 ATP 的形成。
测量
编辑化学系统的焓本质上是它的能量。 反应的焓变 ΔH 等于在恒定压力下没有电能输入或输出的情况下从(或进入)封闭系统传出(或传入)的热量 q。 使用量热法测量化学反应中的热量产生或吸收,例如 用炸弹量热计。 一种常见的实验室仪器是反应量热计,用于监测流出或流入反应容器的热流。 可以特别准确地测量燃烧反应的放热和相应的能量变化 ΔH。
放热反应中释放的测量热能转换为 ΔH⚬,单位为焦耳每摩尔(以前称为 cal/mol)。 标准焓变ΔH⚬本质上是反应中的化学计量系数被认为是反应物和产物的量(摩尔)时的焓变; 通常,初始和最终温度假定为 25 °C。 对于气相反应,ΔH⚬ 值与键能相关,可以通过以下方式很好地近似:
ΔH⚬ = 反应物的总键能 − 产物的总键能
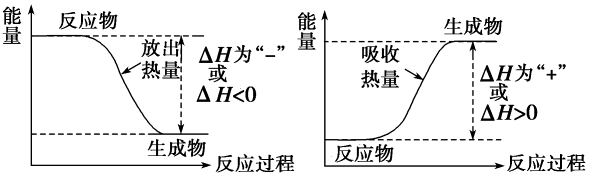
根据定义,在放热反应中,焓变具有负值:
ΔH = HProducts – Hreactants < 0
从较小的值(产物的较低能量)中减去较大的值(反应物的较高能量)。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/216434/
