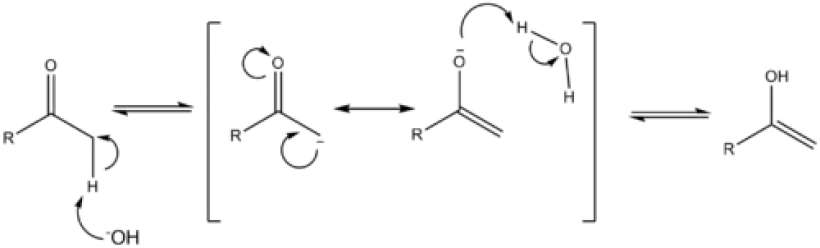
简介
编辑在烯醇和烯酸酯酮化的立体化学中,提供了解释某些烯醇和烯酸酯转化为相应酮时观察到的非对映选择性的理论。1955年提出,烯醇类的动力学质子化是在α碳接近SP2杂化的早期过渡状态下进行的。质子供体选择性地接近烯醇的受阻面,从而导致两个非对映体中较不稳定的那个。
以这种方式控制的反应包括(a)丙二酸的脱羧(b)β-酮酸的脱羧(c)亲核物对不饱和羰基化合物的迈克尔加成(d)烯酮的伯奇还原(e)羰基化合物的去质子化-质子化(f)α-卤代烃的脱卤(f)诺里什II型反应等等。动力学或热力学控制从烯醇受阻程度较低的一面进行质子化,导致两个先验的非对映体中较不稳定的一个。
在这个例子中,有两个不同的反应产生了作为瞬时中间物的烯醇。一个是用丙酮中的稀HI处理α-溴代酮。第二个是烯醇醋酸酯与甲基锂的反应。这两个反应中的第 一个反应是微观可逆性的一个例子。
反应
编辑这是一个酮的溴化反应,众所周知,这个反应是通过烯醇作为中间物进行的。这是一个具有极端立体选择性的例子,因为乙烷桥有严重的立体阻碍。在酸性催化剂和碱性催化剂(如乙氧基钠)的作用下,可以达到热力学平衡。
现在形成的非对映体的乙酰基处于赤道上。图2.非对映体通过共同的烯醇进行平衡。图3显示了两个苯基-吡啶基非对映体的酮化结果。在左边的外吡啶异构体中,通常的立体阻碍控制阻止了来自上方的质子化。也就是说,苯基位于烯醇α碳的正上方,质子化必须从下方发生。
相反,在右边的内向吡啶异构体的情况下,碱性吡啶基证明能够首先拾取质子,然后从这个上部受阻的一侧将其传递到α-碳。分子内质子传递的结果是与常见的立体化学相反。
图3.两个苯基-吡啶基的烯醇非对映体。一个典型的例子;一个由α-溴代酮生成的烯醇图4.4-苯基-1-苯甲酰环己烷的烯醇酮化的例子。在这个例子中,以锌为试剂,从1-溴-1-苯甲酰-4-苯基环己烷的顺式或反式异构体中生成烯醇中间体。
内向质子的方法被两个轴向的氢所阻断。这个例子比前面的例子更典型,因为立体选择性只在60%到70%之间,有利于形成(不太稳定的)顺式产品。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/160649/
