什么是轨道杂化
编辑在化学中,轨道杂化(或杂交)是混合原子轨道的概念,以形成新的杂交轨道(具有与组成原子轨道不同的能量、形状等),适合电子配对形成价键理论的化学键。例如,在一个形成四个单键的碳原子中,价壳s轨道与三个价壳p轨道结合,形成四个等价的SP3混合物,在碳周围呈四面体排列,与四个不同的原子结合。混合轨道在解释分子几何学和原子结合特性时很有用,并且在空间中是对称排列的。通常混合轨道是由能量相当的原子轨道混合形成的。
轨道杂化的概述
编辑轨道是分子内电子行为的一种模型表示。在简单杂化的情况下,这种近似是以原子轨道为基础的,类似于氢原子的轨道,氢原子是唯一可以精确解决薛定谔方程的中性原子。在较重的原子中,如碳、氮和氧,所用的原子轨道是2S和2P轨道,类似于氢的激发态轨道。混合轨道被认为是原子轨道的混合物,以不同比例相互叠加。例如,在甲烷中,形成每个碳-氢键的C混合轨道由25%的s特性和75%的p特性组成,因此被描述为sp3(读作s-p-3)杂化。量子力学将这种杂化描述为形式为N(s+√3pσ)的sp3波函数,其中N是一个归一化常数(这里是1/2),pσ是一个沿C-H轴指向的p轨道,形成一个西格玛键。在这个例子中,系数的比率(一般表示为λ)为√3。由于与一个轨道相关的电子密度与波函数的平方成正比,所以p字与s字的比率为λ2=3。p特性或p成分的重量是N2λ2=3/4。
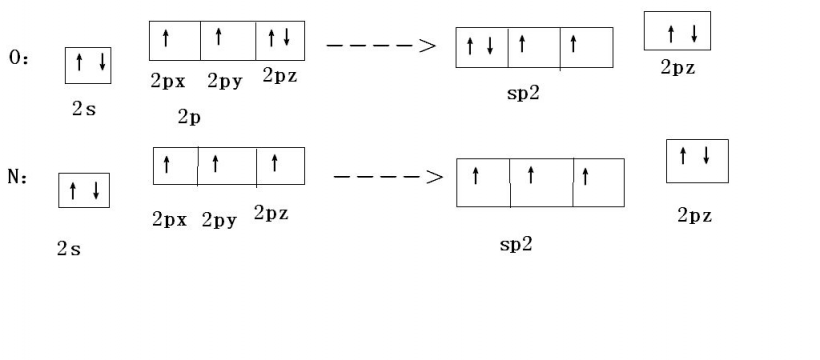
杂化的类型
编辑sp3杂化从原子的角度描述原子的结合。对于一个四面体配位的碳(如甲烷CH4)来说,碳应该有4个具有正确对称性的轨道来与4个氢原子结合。碳的基态构型是1s22s22p2,或者更容易理解。碳原子可以利用其两个单占的p型轨道与两个氢原子形成两个共价键,产生单质亚甲基CH2,即最简单的碳化物。碳原子还可以通过激发(或促进)一个电子从双占的2S轨道到空的2P轨道与四个氢原子结合,产生四个单占轨道。形成两个额外键所释放的能量超过了所需的激发能量,在能量上有利于形成四个C-H键。从量子力学上讲,如果四个键是等价的,就可以得到最低的能量,这就要求它们是由碳上的等价轨道形成。可以得到一组四个等价轨道,它们是价壳(核心轨道几乎不参与成键)s和p波函数的线性组合,这就是四个sp3杂化体。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/160888/
