奥斯特瓦尔德法简介
编辑奥斯特瓦尔德法是一种用于制造硝酸 (HNO3) 的化学工艺。 威廉·奥斯特瓦尔德 (Wilhelm Ostwald) 开发了该工艺,并于 1902 年为其申请了专利。奥斯特瓦尔德法是现代化学工业的中流砥柱,它为最常见的化肥生产提供了主要原材料。 从历史上和实践上看,奥斯特瓦尔德法与哈伯工艺密切相关,哈伯工艺提供必要的原材料氨 (NH3)。
描述
编辑第一阶段
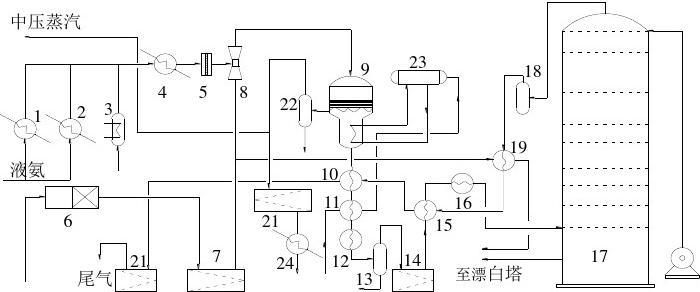
编辑氨分两个阶段转化为硝酸。 在催化剂如含 10% 铑的铂、熔融石英棉、铜或镍上的铂金属的存在下,通过用氧气加热将其氧化,形成一氧化氮(氮 (II) 氧化物)和水(以蒸汽形式存在)。 该反应强烈放热,一旦开始就成为有用的热源:
4 NH 3 ( g ) + 5 O 2 ( g ) ⟶ 4 NO ( g ) + 6 H 2 O ( g ) {dISPlaystyle {ce {4 NH3 (g) + 5 O2 (g) -> 4 NO (g) + 6 H2O (g)}}} (ΔH = −905.2 kJ/mol)
第 2 阶段
编辑第二阶段包括两个反应,并在含水的吸收装置中进行。 最初一氧化氮再次被氧化产生二氧化氮(氧化氮(IV))。 然后这种气体很容易被水吸收,产生所需的产物(硝酸,尽管是稀释形式),同时将其中一部分还原为一氧化氮:
2 NO ( g ) + O 2 ( g ) ⟶ 2 NO 2 ( g ) {diSPlaystyle {ce {2 NO (g) + O2 (g) -> 2 NO2 (g)}}} (ΔH = −114 kJ/mol)3 NO 2 ( g ) + H 2 O ( l ) ⟶ 2 HNO 3 ( aq ) + NO ( g ) {displaystyle {ce {3 NO2 (g) + H2O (l) -> 2 HNO3 (aq) + NO (g)}}} (ΔH = −117 kJ/mol)
并且,如果最后一步是在空中进行:
4 NO 2 ( g ) + O 2 ( g ) + 2 H 2 O ( l ) ⟶ 4 HNO 3 ( aq ) {displaystyle {ce {4 NO2 (g) + O2 (g) + 2 H2O ( l)-> 4 HNO3 (aq)}}} (ΔH = −348 kJ/mol)。[在吸收塔中]。
第一阶段的典型条件(有助于约 98% 的总产率)是:
需要考虑的一个并发症是第一步中的副反应,将一氧化氮还原为氮气:
4 NH 3 + 6 NO ⟶ 5 N 2 + 6 H 2 O {displaystyle {ce {4 NH3 + 6 NO ->; 5 N2 + 6 H2O}}}
总体反应
编辑总反应是第一个方程的总和,3次第二个方程,2次最后一个方程; 全部除以 2:
2 NH 3 ( g ) + 4 O 2 ( g ) + H 2 O ( l ) ⟶ 3 H 2 O ( g ) + 2 HNO 3 ( aq ) {displaystyle {ce {2 NH3 (g) + 4 O2 (g) + H2O (l) -> 3 H2O (g) + 2 HNO3 (aq)}}} (ΔH = −740.6 kJ/mol)
或者,如果最后一步在空气中进行,则总反应是方程式 1、2 乘以方程式 2 和方程式 4 的总和; 全部除以 2。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/204056/
