沸点升高
编辑沸点升高描述了当加入另一种化合物时液体(溶剂)的沸点会更高的现象,意味着溶液的沸点高于纯溶剂。 每当将非挥发性溶质(例如盐)添加到纯溶剂(例如水)中时,就会发生这种情况。 可以使用沸点仪准确测量沸点。
说明
编辑沸点升高是一种依数性,这意味着它取决于溶解颗粒的存在及其数量,而不是它们的特性。 它是在溶质存在下稀释溶剂的结果。 这种现象发生在所有溶液中的所有溶质中,即使在中也是如此,并且不依赖于任何特定的溶质-溶剂相互作用。 当溶质是电解质(例如各种盐)和非电解质时,沸点升高都会发生。 用热力学术语来说,沸点升高的起因是熵,可以用溶剂的蒸气压或化学势来解释。 在这两种情况下,解释都基于这样一个事实,即许多溶质仅存在于液相中而不会进入气相(除非在极高温度下)。
用蒸气压术语来说,当液体的蒸气压等于周围压力时,液体会在该温度下沸腾。 对于溶剂,溶质的存在会通过稀释降低其蒸气压。 非挥发性溶质的蒸气压为零,因此溶液的蒸气压小于溶剂的蒸气压。 因此,蒸汽压达到周围压力需要更高的温度,并且沸点升高。
用化学势术语来说,在沸点时,液相和气相(或气相)具有相同的化学势(或蒸气压),这意味着它们在能量上是等效的。 化学势取决于温度,在其他温度下,液相或气相具有较低的化学势并且比其他相在能量上更有利。 这意味着当加入非挥发性溶质时,液相中溶剂的化学势因稀释而降低,但气相中溶剂的化学势不受影响。 这反过来意味着液相和气相之间的平衡是在与纯液体不同的溶液温度下建立的,即沸点升高。
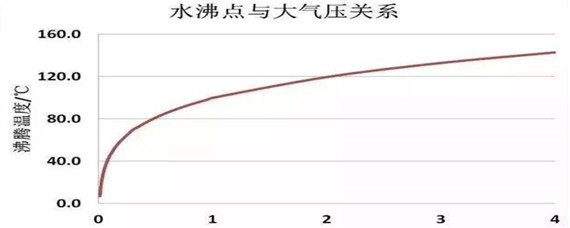
冰点降低的现象类似于沸点升高。 但是,对于相同溶剂和相同浓度的溶质,凝固点降低的幅度大于沸点升高的幅度。 由于这两种现象,溶剂的液体范围在溶质存在下增加。
稀浓度计算公式
编辑沸点升高的程度可以应用克劳修斯-克拉佩龙关系和拉乌尔定律以及溶质不挥发的假设来计算。 结果是,在稀释的理想溶液中,沸点升高的程度与溶液的摩尔浓度(每质量物质的量)成正比,
其中沸点升高定义为 Tb(溶液)- Tb(纯溶剂)。
- Kb,沸点常数,取决于溶剂的性质。 它可以计算为 Kb = RTb2M/ΔHv,其中 R 是气体常数,Tb 是纯溶剂的沸点 [以 K 为单位],M 是溶剂的摩尔质量,ΔHv 是蒸发热每 溶剂的摩尔数。
- bc 是依数摩尔浓度,通过考虑解离来计算,因为沸点升高是依数性质,取决于溶液中的粒子数。 这最容易通过使用 van ‘t Hoff 因子 i 作为 bc = bsolute · i 来完成,其中 bsolute 是溶液的摩尔浓度。 因子 i 表示溶液中化合物形成的单个粒子(通常是离子)的数量。 例子:
非整数 i 因子由溶液中的离子对产生,它降低了溶液中的有效粒子数。
包含 van ‘t Hoff 因子后的方程
ΔTb = Kb · 绝对 · i
在高浓度下,由于溶液的非理想性,上述公式不太精确。 如果溶质也是挥发性的,则用于推导公式的关键假设之一是不正确的,因为它是针对非挥发性溶质的溶液推导的。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214185/
