气体分压
编辑在气体混合物中,每种成分气体都有一个分压,该分压是该成分气体的名义压力,就好像它单独占据了相同温度下原始混合物的整个体积一样。 理想气体混合物的总压力是混合物中气体分压的总和(道尔顿定律)。
气体的分压是气体分子热力学活动的量度。 气体根据其分压而不是根据其在气体混合物或液体中的浓度溶解、扩散和反应。 气体的这种一般特性在生物学中气体的化学反应中也是如此。 例如,人体呼吸所需的氧气量和有毒的氧气量仅由氧气的分压决定。 对于存在于各种吸入呼吸气体中或溶解在血液中的各种不同浓度的氧气,情况都是如此; 因此,混合比,如可呼吸的 20% 氧气和 80% 氮气,是由体积而不是重量或质量决定的。 此外,氧气和二氧化碳的分压是动脉血气测试中的重要参数。 也就是说,这些压力也可以在例如脑脊液中测量。
符号
编辑压力的符号通常为P或p,可以用下标表示压力,气体种类也用下标表示。 合并时,这些下标将递归应用。
道尔顿分压定律
编辑道尔顿定律表达了这样一个事实,即理想气体混合物的总压力等于混合物中各种气体的分压之和。 这种等式源于这样一个事实,即在理想气体中,分子之间的距离如此之远,以至于它们之间不会相互作用。 大多数实际的现实世界气体都非常接近这个理想值。
理想气体混合物
编辑理想情况下,分压比等于分子数比。 也就是说,理想气体混合物中单个气体组分的摩尔分数 x i {dISPlaystyle x_{mathrm {i} }} 可以用组分的分压或组分的摩尔数
并且可以使用以下表达式获得理想气体中单个气体成分的分压
气体混合物中气体组分的摩尔分数等于气体混合物中该组分的体积分数。
- VX 是任何单个气体组分 (X) 的部分体积
- Vtot 是混合气体的总体积
- pX为气体X的分压
- ptot 是混合气体的总压力
- nX为气体物质的量(X)
- ntot 是气体混合物中物质的总量
分体积(Amagat加体积定律)
编辑混合物中特定气体的部分体积是气体混合物中一种组分的体积。 它在气体混合物中很有用,例如 空气,专注于一种特定的气体成分,例如 氧。
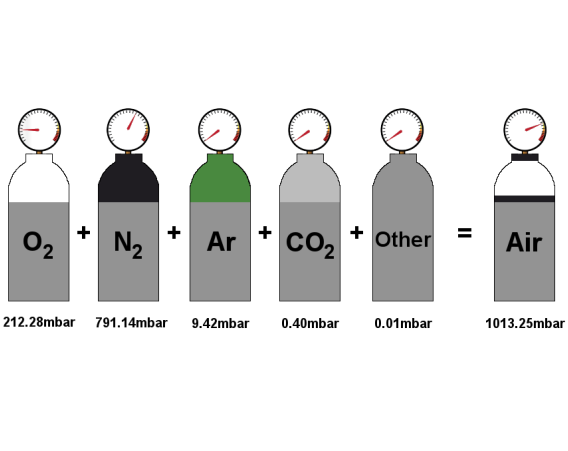
- VX 是混合物中单个气体组分 X 的部分体积
- Vtot 是混合气体的总体积
- pX为气体X的分压
- ptot 是混合气体的总压力
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214246/
