镧系收缩
编辑镧系收缩是镧系元素的原子半径/离子半径从原子序数 57 镧到 71 镥的大于预期的减少,这导致小于其他预期的原子半径/离子半径 以 72,铪开头的后续元素。
原因
编辑该效应是由于 4f 电子对核电荷(核对电子的吸引力)的屏蔽不良所致; 6s 电子被吸引到原子核,从而导致更小的原子半径。
在单电子原子中,电子与原子核的平均间距由它所属的亚壳层决定,并随着原子核上电荷的增加而减小; 这反过来又导致原子半径减小。 在多电子原子中,核电荷增加导致的半径减小部分被电子间静电排斥力的增加所抵消。
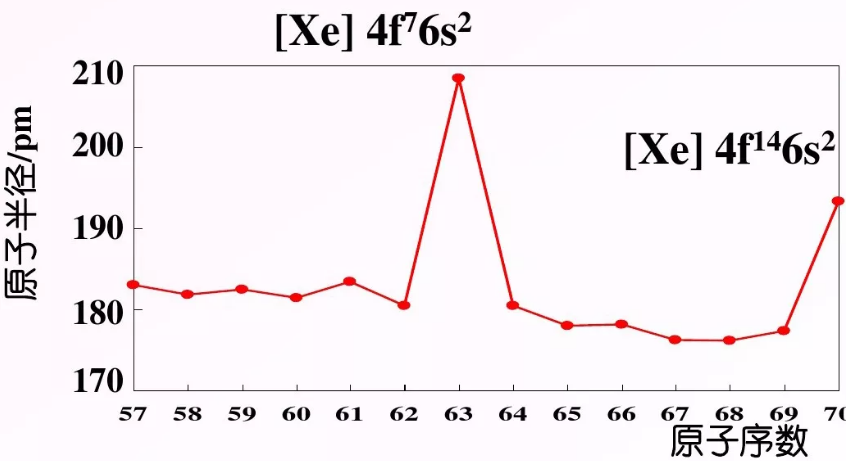
特别是,屏蔽效应会起作用:即,当电子被添加到外壳中时,已经存在的电子会屏蔽外层电子免受核电荷的影响,从而使它们在核上的有效电荷较低。 由内部电子施加的屏蔽效应以s>1的顺序降低。
通常,随着特定子壳在一段时间内被填充,原子半径会减小。 这种效果在镧系元素的情况下尤为明显,因为填充在这些元素上的 4f 亚壳层在屏蔽外壳(n=5 和 n=6)电子方面不是很有效。 因此,屏蔽效应无法抵消由核电荷增加引起的半径减小。 这导致镧系收缩。 离子半径从镧 (III) 的 103 pm 下降到镥 (III) 的 86.1 pm。
大约 10% 的镧系收缩归因于相对论效应。
效果
编辑镧系元素外层电子吸引力增加的结果可分为对镧系元素本身的影响,包括离子半径的减小,以及对后续或后镧系元素的影响。
镧系元素的性质
编辑随着电子添加到 4f 壳层,镧系元素的离子半径从 103 pm (La3+) 减小到 86 pm (Lu3+)。 第一个 f 层位于完整的 5s 和 5p 层(以及中性原子中的 6s 层)内; 4f 壳位于原子核附近,对化学键合几乎没有影响。 然而,原子和离子半径的减少确实影响了它们的化学性质。 如果没有镧系收缩,镧系元素的化学分离将极其困难。
从镧到镥(铕和镱是最显着的例外;在金属状态下,它们是二价而不是三价),维氏硬度、布氏硬度、密度和熔点都有增加的普遍趋势。 镥是最硬、密度最大的镧系元素,熔点最高。
对后镧系元素的影响
编辑元素周期表中镧系元素之后的元素受镧系收缩的影响。
pm(经验值),而铪 Hf(对应的第 6 周期元素)的原子半径为 159 pm。
Zr4+ 的离子半径为 84 pm,Hf4+ 的离子半径为 83 pm。 尽管电子数从 40 增加到 72,原子质量从 91.22 增加到 178.49 g/mol,但半径非常相似。 质量增加和半径不变导致密度从 6.51 急剧增加到 13.35 g/cm3。
因此,锆和铪具有非常相似的化学行为,具有非常相似的半径和电子配置。 与半径相关的性质,如晶格能、溶剂化能和配合物的稳定常数也相似。 由于这种相似性,铪只与锆一起被发现,而锆的含量要丰富得多。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214708/
