自发过程
编辑在热力学中,自发过程是在系统没有任何外部输入的情况下发生的过程。 一个更专业的定义是系统的时间演化,在该过程中,它释放自由能并移动到更低、热力学更稳定的能量状态(更接近热力学平衡)。 自由能变化的符号约定遵循热力学测量的一般约定,其中从系统释放自由能对应于系统自由能的负变化和周围自由能的正变化。
根据过程的性质,自由能的确定方式不同。 例如,在考虑在恒定压力和温度条件下发生的过程时使用吉布斯自由能变化,而在考虑在恒定体积和温度条件下发生的过程时使用亥姆霍兹自由能变化。 两种自由能变化的值甚至符号都取决于温度和压力或体积。
因为自发过程的特点是系统的自由能减少,所以它们不需要由外部能源驱动。
对于涉及不与周围环境交换能量的孤立系统的情况,自发过程的特征是熵增加。
自发反应是在感兴趣的条件下是自发过程的化学反应。
概览
编辑一般来说,一个过程的自发性只决定了一个过程是否会发生,并没有说明这个过程是否会发生。 换句话说,自发性是一个过程实际发生的必要条件,但不是充分条件。 此外,自发性并不暗示自发性可能发生的速度。
例如,金刚石转化为石墨是在室温和压力下的自发过程。 尽管是自发的,但由于破坏强碳-碳键的能量大于释放的自由能,因此该过程不会发生。
利用自由能确定自发性
编辑对于在恒定温度和压力下发生的过程,可以使用吉布斯自由能的变化来确定自发性,其由下式给出:
Δ G = Δ H − T Δ S , {dISPlaystyle Delta G=Delta H-TDelta S,,}
其中 ΔG 的符号取决于焓 (ΔH) 和熵 (ΔS) 变化的符号。 如果这两个符号相同(均为正或均为负),则在温度 T = ΔH/ΔS 时,ΔG 的符号将从正变为负(反之亦然)。
在 ΔG 为:
- 否定的,该过程是自发的并且可能按照书面的正向进行。
- 积极的,如所写,该过程不是自发的,但它可能会自发地朝相反的方向进行。
- 零,过程处于平衡状态,随着时间的推移没有发生净变化。
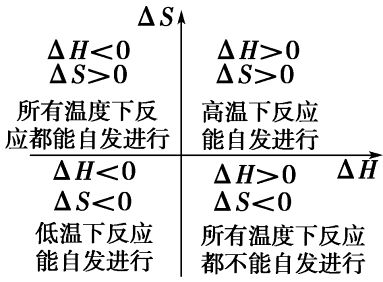
这组规则可用于通过检查 ΔS 和 ΔH 的符号来确定四种不同的情况。
- 当 ΔS > 0 和 ΔH < 0,如所写,过程始终是自发的。
- 当 ΔS < 0 和 ΔH > 0,过程永远不是自发的,但逆过程总是自发的。
- 当 ΔS > 0 和 ΔH > 0,该过程在高温下是自发的,在低温下是非自发的。
- 当 ΔS < 0 和 ΔH < 0,该过程在低温下是自发的,在高温下是非自发的。
对于后两种情况,自发性变化的温度将由 ΔS 和 ΔH 的相对大小决定。
使用熵来确定自发性
编辑使用过程的熵变来评估自发性时,重要的是要仔细考虑系统和环境的定义。 热力学第二定律指出,如果系统的熵随时间增加,则涉及孤立系统的过程将是自发的。 然而,对于开放或封闭系统,必须修改该陈述以说明组合系统和周围环境的总熵必须增加
然后可以使用此标准来解释开放或封闭系统的熵如何在自发过程中减少。 只有当周围环境的熵变符号为正且幅度大于系统的熵变时,系统熵的减少才会自发地发生。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/215913/
