半反应
编辑半反应(或半电池反应)是氧化还原反应的氧化或还原反应成分。 半反应是通过考虑参与氧化还原反应的单个物质的氧化态变化而获得的。通常,半反应的概念用于描述电化学电池(例如原电池)中发生的情况。 可以写出半反应来描述经历氧化的金属(称为阳极)和经历还原的金属(称为阴极)。
半反应通常用作平衡氧化还原反应的方法。 对于酸性条件下的氧化还原反应,平衡原子数和氧化数后,需要加入H+离子来平衡半反应中的氢离子。 对于碱性条件下的氧化还原反应,在平衡原子和氧化数后,先将其视为酸性溶液,然后加入OH-离子以平衡半反应中的H+离子(会生成H2O)。
示例:锌和铜原电池
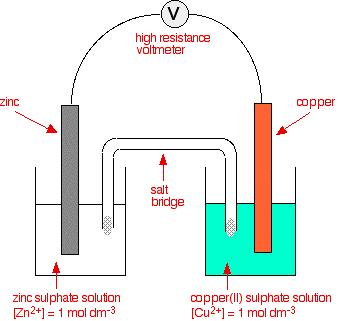
编辑考虑相邻图像中显示的原电池:它由一块浸没在硫酸锌 (ZnSO4) 溶液中的锌 (Zn) 和一块浸没在硫酸铜 (II) 溶液中的铜 (Cu) 构成( 硫酸铜)。 总体反应是:
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
在 Zn 阳极,发生氧化(金属失去电子)。 这在以下氧化半反应中表示(注意电子在产物侧):
Zn(s) → Zn2+ + 2e−
在 Cu 阴极,发生还原(接受电子)。 这在以下还原半反应中表示(注意电子在反应物一侧):
Cu2+ + 2e− → Cu(s)
例子:镁的氧化
编辑以镁带 (Mg) 的燃烧为例。 当镁燃烧时,它根据以下方程式与空气中的氧气 (O2) 结合形成氧化镁 (MgO):
2Mg(s) + O2(g) → 2MgO(s)
氧化镁是一种离子化合物,包含 Mg2+ 和 O2- 离子,而 Mg(s) 和 O2(g) 是不带电荷的元素。 零电荷的 Mg(s) 从反应物侧到产物侧获得 +2 电荷,零电荷的 O2(g) 获得 -2 电荷。 这是因为当Mg(s)变成Mg2+时,它失去了2个电子。 由于左侧有 2 个 Mg,根据以下氧化半反应,总共失去 4 个电子:
2Mg(s) → 2Mg2+ + 4e−
另一方面,O2 被还原:其氧化态从 0 变为 -2。 因此,当 O2 获得 4 个电子时,可以写出还原半反应:
O2(g) + 4e− → 2O2−
总反应是两个半反应的总和:
2Mg(s) + O2(g) + 4e− →2Mg2+ + 2O2− + 4e−
当发生化学反应,特别是氧化还原反应时,我们看不到电子在反应过程中的出现和消失。 我们看到的是反应物(起始材料)和最终产物。 因此,出现在等式两边的电子被抵消了。 抵消后,方程改写为
2Mg(s) + O2(g) →2Mg2+ + 2O2−
两个离子,正 (Mg2+) 和负 (O2-) 存在于产品侧,由于它们的相反电荷(静电吸引),它们立即结合形成复合氧化镁 (MgO)。 在任何给定的氧化还原反应中,都有两个半反应——氧化半反应和还原半反应。 这两个半反应的总和就是氧化还原反应。
半反应平衡法
编辑考虑以下反应:
Cl2 + 2Fe2+ → 2Cl− + 2Fe3+
所涉及的两种元素,铁和氯,各自改变氧化态; 铁从+2到+3,氯从0到-1。 然后实际上发生了两个半反应。 这些变化可以通过在每个半反应中插入适当的电子来表示在公式中:
Fe2+ → Fe3+ + e−Cl2 + 2e− → 2Cl−
给定两个半反应,在了解适当的电极电势的情况下,有可能以相同的方式达到完整(原始)反应。 将反应分解为半反应是理解各种化学过程的关键。 例如,在上述反应中,可以证明这是一个氧化还原反应,Fe被氧化,Cl被还原。 注意电子从 Fe 转移到 Cl。 分解也是一种简化化学方程式平衡的方法。 化学家一次可以对一个方程式进行原子平衡和电荷平衡。
也有可能而且有时有必要考虑在碱性或酸性条件下的半反应,因为在氧化还原反应中可能存在酸性或碱性电解质。 由于这种电解质,可能更难满足原子和碳的平衡。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/216013/
