发射光谱
编辑化学元素或化合物的发射光谱是由于电子从高能态跃迁到较低能态而发射的电磁辐射的频谱。 发射光子的光子能量等于两种状态之间的能量差。 每个原子有很多可能的电子跃迁,每个跃迁都有特定的能量差。 这种导致不同辐射波长的不同跃迁的集合构成了发射光谱。 每个元素的发射光谱都是独一无二的。 因此,光谱学可用于鉴定未知成分物质中的元素。 同样,分子的发射光谱可用于物质的化学分析。
发射
编辑在物理学中,发射是通过发射光子将粒子的较高能量量子力学状态转换为较低能量状态,从而产生光的过程。 发射光的频率是跃迁能量的函数。
由于能量必须守恒,两种状态之间的能量差等于光子带走的能量。 跃迁的能量状态可以导致在非常大的频率范围内发射。 例如,可见光是由原子和分子中的电子态耦合发出的(这种现象称为荧光或磷光)。 另一方面,核壳层跃迁可以发射高能伽马射线,而核自旋跃迁则发射低能无线电波。
物体的发射率量化了它发出的光量。 这可能通过 Stefan-Boltzmann 定律与物体的其他属性有关。对于大多数物质,发射量随温度和物体的光谱成分而变化,导致色温和发射线的出现。 许多波长的精确测量允许通过发射光谱识别物质。
辐射的发射通常使用半经典量子力学来描述:粒子的能级和间距由量子力学确定,光被视为振荡电场,如果它与系统共振,则可以驱动跃迁 的固有频率。 量子力学问题是用时间相关的微扰理论来处理的,并导致了被称为费米黄金法则的一般结果。 该描述已被量子电动力学所取代,尽管半经典版本在大多数实际计算中仍然更有用。
起源
编辑当原子中的电子被激发时,例如通过加热,额外的能量将电子推向更高能量的轨道。 当电子回落并离开激发态时,能量以光子的形式重新发射。 光子的波长(或等效的频率)由两种状态之间的能量差决定。 这些发射的光子形成元素的光谱。
只有特定颜色出现在元素的原子发射光谱中这一事实意味着只有特定频率的光被发射。 这些频率中的每一个都通过以下公式与能量相关:E photon = h ν , {dISPlaystyle E_{text{photon}}=hnu ,} 其中 E photon {diSPlaystyle E_{text {photon}}} 是光子的能量,ν {displaystyle nu } 是它的频率,h {displaystyle h} 是普朗克常数。由此得出结论,只有特定能量的光子才会被发射 由原子。 原子发射光谱的原理解释了霓虹灯的不同颜色,以及化学火焰测试结果(如下所述)。
原子可以发射的光的频率取决于电子可以处于的状态。当被激发时,电子移动到更高的能级或轨道。 当电子回落到其基电平时,就会发出光。
上图显示了氢的可见光发射光谱。 如果只有一个氢原子存在,那么在给定的瞬间只能观察到一个波长。 由于样本中包含许多处于不同初始能量状态并达到不同最终能量状态的氢原子,因此观察到了几种可能的排放。 这些不同的组合导致不同波长的同时发射。
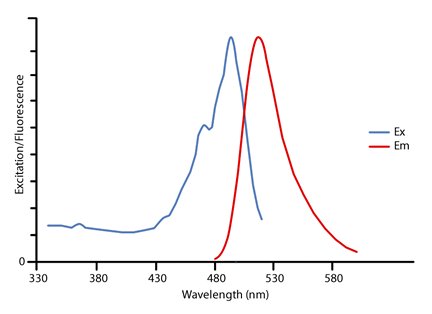
分子辐射
编辑除了上面讨论的电子跃迁外,分子的能量也可以通过旋转、振动和电子振动(结合振动和电子)跃迁而改变。 这些能量跃迁通常会导致许多不同光谱线的间隔很近的组,称为光谱带。 未解析的波段光谱可能显示为光谱连续体。
发射光谱学
编辑光由不同波长的电磁辐射组成。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/220140/
