什么是膜片钳
编辑膜片钳是一种电生理学实验室技术,用于研究单个分离的活细胞、组织切片或细胞膜贴片中的离子电流。该技术特别适用于神经元、心肌细胞、肌纤维和胰腺β细胞等可兴奋细胞的研究,也可应用于专门制备的巨型原生质球中细菌离子通道的研究。
可以使用电压钳位技术执行贴片钳位。在这种情况下,细胞膜上的电压由实验者控制,并记录产生的电流。或者,可以使用电流钳技术。在这种情况下,通过膜的电流由实验者控制,并记录由此产生的电压变化,通常以动作电位的形式。
ErwinNeher和BertSakmann在1970年代末和1980年代初开发了膜片钳。这一发现首次使记录单个离子通道分子的电流成为可能,从而提高了对通道参与基本细胞过程(如动作电位和神经活动)的理解。Neher和Sakmann因这项工作获得了1991年的诺贝尔生理学或医学奖。
膜片钳基本技术
编辑设置
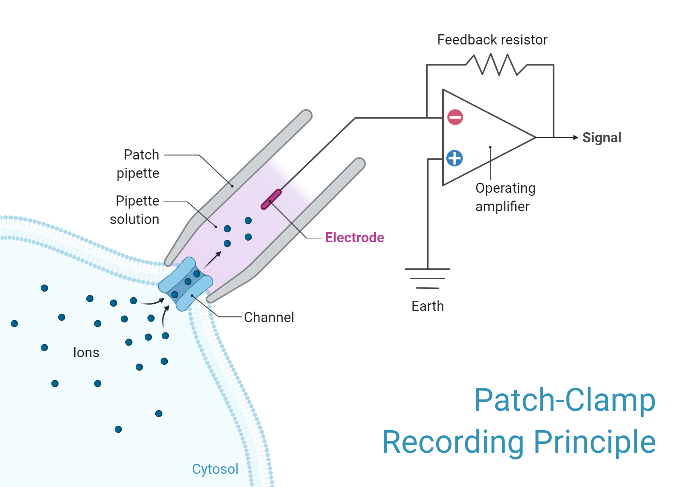
在膜片钳记录过程中,被称为微量移液器或膜片移液器的中空玻璃管充满电解质溶液和连接到放大器的记录电极与隔离细胞的膜接触。另一个电极放置在围绕细胞或组织的浴槽中作为参考接地电极。可以在记录电极和参考电极之间形成电路,感兴趣的细胞位于其间。
用于制备用于膜片钳和其他记录的微量移液器的移液器拉拔器装置的示意图在全细胞或穿孔膜片钳期间形成的电路
填充贴片吸管的溶液可能与浴液的离子成分相匹配,如在细胞附着记录的情况下,或与细胞质相匹配,用于全细胞记录。浴液中的溶液可能与生理细胞外溶液、细胞质相匹配,或者完全是非生理的,这取决于要进行的实验。研究人员还可以通过添加离子或药物来研究不同条件下的离子通道,从而改变浴液(或不太常见的移液器溶液)的含量。
根据研究人员试图测量的内容,所用移液器吸头的直径可能会有所不同,但通常在微米范围内。这种小尺寸用于包围通常仅包含一个或几个离子通道分子的细胞膜表面区域或“补丁”。这种类型的电极与传统细胞内记录中用于刺穿细胞的“尖锐微电极”不同,它被密封在细胞膜表面,而不是通过它插入。
在一些实验中,微量移液管尖端在微锻造中被加热以产生光滑的表面,这有助于与细胞膜形成高电阻密封。为了获得这种高阻力密封,将微量移液器压在细胞膜上并施加吸力。细胞膜的一部分被吸入移液管,形成一个欧米茄形的膜区域,如果形成正确,会产生10-100吉欧范围内的电阻,称为“千兆欧密封”或“千兆密封”。这种密封件的高电阻使得能够以电子方式隔离通过薄膜贴片测量的电流,而几乎没有竞争噪声,以及为录音提供一些机械稳定性。
录音
许多膜片钳放大器不使用真正的电压钳电路,而是使用浴电极设置零电流(接地)电平的差分放大器。这允许研究人员在观察电流变化的同时保持电压恒定。为了进行这些记录,将贴片移液器与接地电极进行比较。然后将电流注入系统以保持恒定的设定电压。钳位电压所需的电流与通过膜的电流符号相反且大小相等。
或者,细胞可以在全细胞模式下进行电流钳位,保持电流恒定,同时观察膜电压的变化。
穿孔补丁
膜片钳方法的这种变化与全细胞配置非常相似。主要区别在于,当实验者形成千兆欧密封时,不使用吸力来破裂贴膜。相反,电极溶液含有少量抗真菌剂或抗生素,例如两性霉素-B、制霉菌素或短杆菌肽,它们会扩散到膜贴片中并在膜中形成小孔,从而为细胞内部提供电通路。在比较全细胞和穿孔贴片方法时,可以将全细胞贴片视为一扇敞开的门,移液管溶液中的分子与细胞质之间发生完全交换。穿孔的贴片可以比作一个纱门,它只允许某些分子从移液管溶液交换到细胞的细胞质。
相对于全细胞记录,穿孔贴片方法的优点包括抗生素孔的特性,它只允许贴片吸管和细胞溶胶之间的小单价离子平衡,但不能平衡不能通过孔的较大分子。这种特性保持了二价离子(如Ca2+)和信号分子(如cAMP)的内源水平。因此,可以记录整个细胞,如全细胞膜片钳,同时保留大多数细胞内信号传导机制,如细胞附着记录。结果,减少了电流损耗,并且稳定的穿孔补丁记录可以持续超过一小时。缺点包括由于部分膜占据电极尖端,相对于全细胞而言,访问电阻较高。这可能会降低当前分辨率并增加录制噪音。抗生素穿孔膜也可能需要很长时间(两性霉素B大约需要15分钟,短杆菌肽和制霉菌素需要更长的时间)。电极尖端下方的膜被抗生素形成的穿孔削弱并可能破裂。如果贴片破裂,则记录会以全细胞模式进行,抗生素会污染细胞内部。
松散补丁
松散膜片钳与此处讨论的其他技术不同,它采用松散密封(低电阻)而不是传统技术中使用的紧密千兆密封。这种技术早在1961年就被使用,正如Strickholm在一篇关于肌肉细胞表面阻抗的论文中所描述的那样,但在被Almers、Stanfield和Stühmer再次提出并命名之前,几乎没有受到关注1982年后膜片钳被确立为电生理学的主要工具。
为了在细胞膜上实现松动的膜片钳,移液器缓慢地移向细胞,直到细胞和移液器之间的接触电阻增加到比电极单独电阻大几倍的电阻。移液器离膜越近,移液器吸头的阻力就越大,但如果太靠近会形成密封,并且很难在不损坏细胞的情况下取出移液器。对于松散贴片技术,移液器没有足够靠近膜以形成千兆密封或xxx连接,也无法刺穿细胞膜。细胞膜保持完整,缺乏紧密密封会产生一个小间隙,离子可以通过该间隙穿过细胞外而不会进入移液器。
松式密封的一个显着优点是使用的移液器可以在记录后反复从膜上取下,而膜将保持完整。这允许在同一池的多个位置重复测量,而不会破坏膜的完整性。这种灵活性对于研究肌肉细胞特别有用,因为它们在真实生理条件下收缩,快速获取记录,并且在不采取严厉措施阻止肌肉纤维收缩的情况下这样做。一个主要缺点是移液管和膜之间的电阻xxx降低,允许电流通过密封件泄漏,并显着降低小电流的分辨率。然而,这种泄漏可以部分纠正,这提供了比较和对比从感兴趣的细胞上不同区域制作的记录的机会。鉴于此,据估计,松散贴片技术可以解析小于1mA/cm2的电流。
补丁序列
该方法结合了细胞成像、RNA测序和膜片钳,用于全面表征多种模式的神经元。由于神经组织是转录组最多样化的细胞群之一,因此将神经元分类为细胞类型以了解它们形成的回路是神经科学家面临的一项重大挑战。事实证明,将经典分类方法与单细胞RNA测序事后结合起来既困难又缓慢。通过结合多种数据模式,例如电生理学、测序和显微镜,Patch-seq允许同时以多种方式表征神经元。目前,与其他测序方法相比,它的吞吐量较低,这主要是由于在神经元上实现成功的膜片钳记录所涉及的手工劳动。目前正在研究自动化膜片钳技术,这也将提高patch-seq的吞吐量。
自动膜片钳
编辑为了在更短的时间内廉价地收集大量数据,已经开发了自动膜片钳系统。此类系统通常包括一次性使用的微流体装置,注射成型或聚二甲基硅氧烷(PDMS)铸造芯片,以捕获一个或多个细胞,以及一个集成电极。
在这种自动化系统的一种形式中,使用压力差来迫使正在研究的细胞被拉向移液管开口,直到它们形成千兆密封。然后,通过将移液管尖端短暂暴露在大气中,从移液管突出的膜部分爆裂,膜现在处于由内向外的构象,位于移液管尖端。在一个完全自动化的系统中,移液器和膜贴片可以通过一系列不同的测试溶液快速移动,从而在记录过程中将不同的测试化合物应用于膜的细胞内侧。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/134403/
