简介
编辑元素磷可以存在于几种同素异形体中,其中最常见的是白色和红色固体。 固体紫色和黑色同素异形体也是已知的。 气态磷以二磷和原子磷形式存在。
白磷
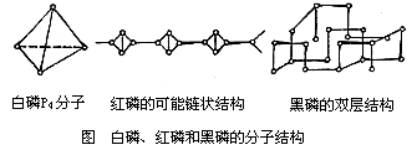
编辑白磷、黄磷或简单的四磷 (P4) 以四面体结构中由四个原子组成的分子形式存在。 四面体排列导致环应变和不稳定性。 该分子被描述为由六个单 P-P 键组成。 已知两种结晶形式。 α形式被定义为元素的标准状态,但实际上在标准条件下是亚稳态的。 它具有体心立方晶体结构,在195.2 K时可逆转变为β型。β型被认为具有六方晶体结构。
白磷是一种半透明的蜡状固体,在光照下会迅速变黄。 因此,它也被称为黄磷。 它在黑暗中(暴露于氧气时)会发出绿色光,并且在与空气接触时高度易燃和自燃(自燃)。 它是有毒的,摄入会导致严重的肝损伤,长期摄入或吸入会导致下巴发麻。 这种形式的燃烧气味具有特征性的大蒜气味,样品通常涂有白色五氧化二磷,其组成为P4O10 个四面体,氧插入在磷原子之间和它们的顶点。 白磷仅微溶于水,可在水下保存。 事实上,白磷只有在浸入水中时才不会自燃; 因此,未反应的白磷可能会对海滩上的人造成危害,他们可能会在不知道其真实性质的情况下收集被冲走的样本。 P4 溶于苯、油类、二硫化碳和二氯化二硫。
生产与应用
编辑可以使用多种方法生产白色同素异形体。 在工业过程中,磷矿在碳和二氧化硅存在的情况下在电炉或燃油炉中加热。 然后元素磷以蒸气形式释放出来,可以在磷酸下收集。 这种碳热反应的理想方程式显示为磷酸钙(尽管磷酸盐岩含有大量的氟磷灰石):
2 Ca3(PO4)2 + 6 SiO2 + 10 C → 6 CaSiO3 + 10 CO + P4
白磷在常温下具有可观的蒸气压。 蒸汽密度表明蒸汽由 P4 分子组成,温度高达约 800 °C。 高于该温度,会分解成 P2 个分子。
它会在大约 50 °C (122 °F) 的空气中自燃,如果细碎(由于熔点降低),则温度会低得多。 磷与氧气反应,通常根据可用氧气量形成两种氧化物:P4O6(三氧化二磷) 氧气供应有限,当与过量氧气反应时,P4O10。 在极少数情况下,P4O7,P4O8 和 P4O9 也形成,但数量很少。 这种燃烧产生氧化磷 (V):
P4 + 5 O2 → P4O10
由于这种特性,白磷被用作武器。
不存在立方 P8
编辑尽管白磷转化为热力学上更稳定的红色同素异形体,但在凝聚相中未观察到立方 P8 分子的形成。 这种假设分子的类似物已从磷炔烃中制备出来。 气态和蜡状固体的白磷由活性 P4 个分子组成。
红磷
编辑红磷可以通过在没有空气的情况下将白磷加热到 300 °C (572 °F) 或将白磷暴露在阳光下而形成。 红磷以无定形网络形式存在。 进一步加热后,无定形红磷结晶。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/205258/
