依数性
编辑在化学中,依数性是指溶液的那些性质,这些性质取决于溶液中溶质粒子数与溶剂粒子数的比率,而不取决于存在的化学物质的性质。 数比可以与溶液浓度的各种单位相关,例如摩尔浓度、质量摩尔浓度、当量浓度(化学)等。溶液性质与溶质粒子性质无关的假设仅适用于,即溶液 表现出类似于理想气体的热力学性质,并且近似于稀释的真实溶液。 换句话说,依数性质是一组解性质,可以通过假设解是理想的来合理地近似。
只考虑非挥发性溶质溶解在挥发性液体溶剂中产生的性质。 它们本质上是溶剂性质,随着溶质的存在而改变。 溶质粒子置换液相中的一些溶剂分子,从而降低溶剂的浓度并增加其熵,因此依数性质与溶质的性质无关。 这表明所有依数性质都有一个共同特征,即它们只与相对于溶剂分子数的溶质分子数有关,而与溶质的性质无关。
依数性包括:
对于给定的溶质-溶剂质量比,所有依数性质都与溶质摩尔质量成反比。
测量非离子化溶质(例如尿素或葡萄糖在水或其他溶剂中的稀溶液)的依数性质可以确定相对摩尔质量,对于小分子和无法通过其他方法研究的聚合物都是如此。 或者,对电离溶质的测量可以导致对发生的解离百分比的估计。
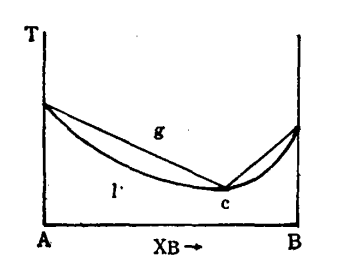
依数性主要针对稀溶液进行研究,其行为可近似为理想溶液的行为。 事实上,上面列出的所有特性仅在稀释极限下是依数性的:在较高浓度下,凝固点降低、沸点升高、蒸气压升高或降低以及渗透压都取决于溶剂的化学性质和 溶质。
蒸气压相对降低
编辑蒸气是在低于其临界点的温度下呈气态的物质。 蒸气压是蒸气与其固态或液态处于热力学平衡时所施加的压力。 当非挥发性溶质溶解在其中形成溶液时,溶剂的蒸气压降低。
如果溶质在溶液中解离,则溶质的摩尔数会增加 van ‘t Hoff 因子 i {dISPlaystyle i} ,它表示每个公式单元的溶质粒子的真实数量。
沸点和冰点
编辑添加溶质以形成溶液可稳定液相中的溶剂,并降低溶剂的化学势,从而使溶剂分子不易移动到气相或固相。 结果,在给定压力下略高于溶剂沸点的液体溶液变得稳定,这意味着沸点升高。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214198/
