盖斯定律
编辑盖斯定律是物理化学中的一个关系式,该定律指出,总焓变 在一个化学反应的整个过程中,它与所采取的步骤的顺序无关。
盖斯定律现在被理解为一个事实的表达,即化学过程的焓独立于从初始状态到最终状态所采取的路径(即焓是状态函数)。 根据热力学第一定律,系统在恒压下发生反应引起的焓变等于吸收的热量(或放出的热量的负值),对于许多反应,这可以通过量热法确定。 这些值通常是针对具有相同初始和最终温度和压力的反应(虽然在反应过程中允许条件变化)。 盖斯定律可用于确定化学反应所需的总能量,该化学反应可分为更容易表征的合成步骤。 这提供了标准生成焓的汇编,可用于预测复杂合成中的焓变。
理论
编辑盖斯定律指出,只要反应物和生成物的初始状态和最终状态相同,无论反应是一步发生还是多步发生,化学反应中的焓变都是相同的。 焓是一个广泛的属性,这意味着它的值与系统大小成正比。 因此,焓变与参与给定反应的摩尔数成正比。
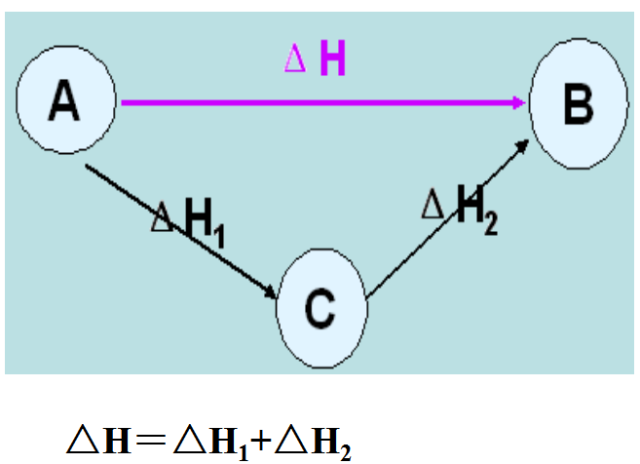
换句话说,如果化学变化通过几种不同的途径发生,则总的焓变是相同的,而不管化学变化发生的途径如何(前提是初始条件和最终条件相同)。 如果这不是真的,那么就可能违反热力学第一定律。
盖斯定律允许计算反应的焓变 (ΔH),即使它不能直接测量。 这是通过使用先前确定的生成焓值根据反应的化学方程式执行基本代数运算来实现的。
化学方程式的组合导致净方程式或整体方程式。 如果已知序列中所有方程的焓变,则它们的总和将是净方程的焓变。 如果净焓变为负,则反应是放热的并且更可能是自发的; 正的 ΔH 值对应于吸热反应。 (熵在确定自发性方面也起着重要作用,因为由于反应系统中的熵增加,一些具有正焓变的反应仍然是自发的。)
生成焓的使用
编辑盖斯定律指出,焓变是相加的。
这里,第一个总和是所有产物 p 的和,第二个是所有反应物 r 的和, ν p {dISPlaystyle nu _{TeXt{p}}} 是产物 p 的化学计量系数。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214236/
