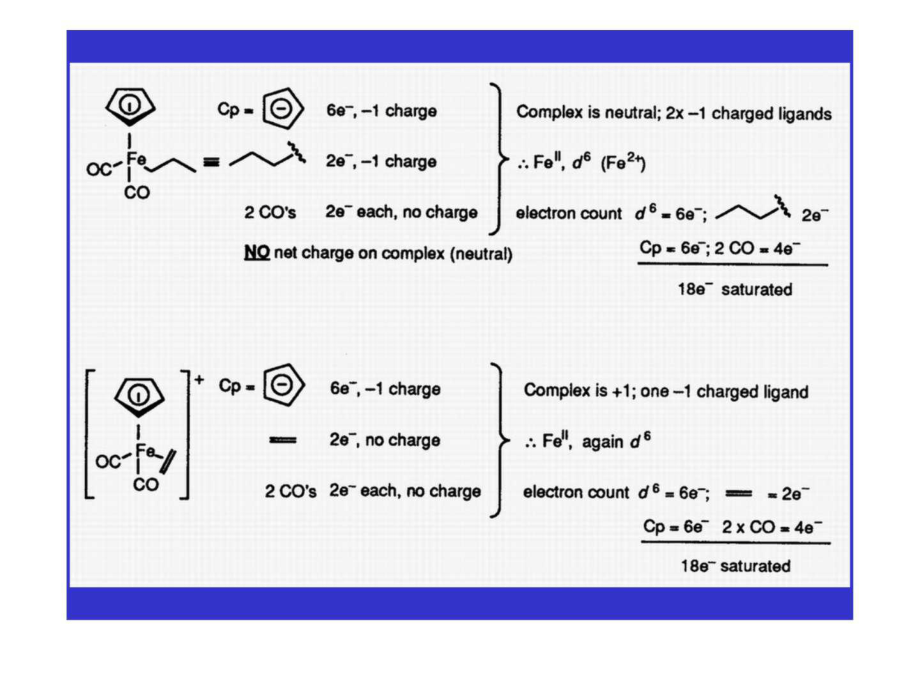
18电子规则
编辑18 电子规则是一种化学经验法则,主要用于预测和合理化稳定过渡金属配合物的公式,尤其是有机金属化合物。 该规则基于以下事实:过渡金属电子构型中的价轨道由五个 (n−1)d 轨道、一个 ns 轨道和三个 np 轨道组成,其中 n 是主量子数。 这些轨道可以共同容纳 18 个电子,作为键合或非键合电子对。 这意味着这九个原子轨道与配体轨道的组合产生了九个金属-配体键合或非键合的分子轨道。 当金属络合物具有 18 个价电子时,据说它在此期间实现了与惰性气体相同的电子构型,从而使络合物具有稳定性。 偏离规则的过渡金属配合物通常很有趣或有用,因为它们往往更具反应性。 该规则对非过渡金属的金属络合物没有帮助。 该规则最早由美国化学家欧文·朗缪尔于 1921 年提出。
适用性
编辑该规则很有用地预测了 Cr、Mn、Fe 和 Co 三元组的低自旋配合物的分子式。 众所周知的例子包括二茂铁、五羰基铁、羰基铬和羰基镍。
复杂的配体决定了 18 电子规则的适用性。 通常,遵守该规则的复合物至少部分由 π 受体配体(也称为 π 酸)组成。 这种配体会产生非常强的配体场,从而降低所得分子轨道的能量,从而使它们更容易被占据。 典型的配体包括烯烃、膦和 CO。π 酸的配合物通常具有低氧化态的金属。 氧化态和配体性质之间的关系在 π backbonding 的框架内被合理化。
反应性的后果
编辑遵守 18 电子规则的化合物通常是交换惰性的。 示例包括 [Co(NH3)6]Cl3、Mo(CO)6 和 [Fe(CN)6]4−。 在这种情况下,配体交换通常通过解离取代机制发生,其中反应速率由配体的解离速率决定。 另一方面,18电子的化合物对质子等亲电子试剂具有很强的反应性,这种反应在机理上是缔合的,属于酸碱反应。
具有少于 18 个价电子的配合物往往表现出增强的反应性。 因此,18 电子规则通常是化学计量或催化意义上的非反应性的配方。
二元组规则
编辑计算结果表明,金属上的价态 p 轨道参与金属-配体键合,尽管很弱。 然而,在自然键轨道的背景下,Weinhold 和 LANDis 不计算金属配体键合中的金属 p 轨道,尽管这些轨道仍作为极化函数包含在内。 这导致只有五个 d 轨道和一个 s 轨道的双面(12 电子)规则。
普通化学界目前的共识是,与主族元素的奇异八位组规则不同,过渡金属不严格遵守 12 电子或 18 电子规则,但规则描述了价电子的下界和上界 分别算。 因此,虽然过渡金属 d 轨道和 s 轨道键合很容易发生,但更高能量和更多空间扩散的 p 轨道参与键合取决于中心原子和配位环境。
例外情况
编辑与金属轨道相互作用小的 π 供体或 σ 供体配体会导致弱配体场,从而增加 t2g 轨道的能量。 这些分子轨道变成非键合或弱反键合轨道(小 Δoct)。 因此,电子的加入或去除对配合物的稳定性影响不大。 在这种情况下,对 d 电子的数量没有限制,具有 12-22 个电子的复合物是可能的。 小的 Δoct 使填充 eg* 成为可能 (>18 e-),π-供体配体可以使 t2g 反键合 (<18 e-)。 这些类型的配体位于光谱化学系列的低到中等部分。 例如:[TiF6]2− (Ti(IV), d0, 12 e−), [Co(NH3)6]3+ (Co(III), d6, 18 e−), [Cu(OH2)6] 2+ (Cu(II), d9, 21 e−)。
就金属离子而言,Δoc随着基团的增加以及氧化数的增加而增加。 强配体场导致低自旋配合物,这导致 18 电子规则的一些例外。
16电子配合物
编辑违反 18e 规则的一类重要配合物是具有金属 d8 配置的 16 电子配合物。 所有高自旋 d8 金属离子都是八面体(或四面体),但低自旋 d8 金属离子都是方形平面。 方形平面低自旋 d8 金属离子的重要示例是 Rh(I)、Ir(I)、Ni(II)、Pd(II) 和 Pt(II)。 下图显示了低自旋方形平面复合物中 d 亚壳层的分裂。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214634/
