成键轨道
编辑在理论化学中,键合轨道在分子轨道 (MO) 理论中用于描述分子中两个或多个原子的原子轨道之间的吸引相互作用。 在 MO 理论中,电子被描述为以波浪形式移动。 当不止一个这些波靠在一起时,这些波的同相组合会产生相互作用,从而导致一个物种非常稳定。 波的相长干涉结果导致电子密度位于结合区域内,从而在两种物质之间形成稳定的结合。
双原子分子
编辑在 H2 MO 的经典示例中,两个独立的 H 原子具有相同的原子轨道。 当产生分子二氢时,单个价轨道 1s 要么: 同相合并以获得键合轨道,其中电子密度位于原子核之间; 或者,异相合并以获得反键合轨道,其中除了两个原子的原子核之间的空间外,电子密度在原子周围无处不在。 键合轨道导致比两个氢是单原子时更稳定的物质。 反键轨道不太稳定,因为中间的电子密度很小甚至没有,两个原子核(带相同电荷)相互排斥。 因此,通过反键轨道将两个原子保持在一起需要更多的能量。 氢的 1 价壳层中的每个电子聚集在一起以填充稳定的键合轨道。 因此,氢更喜欢以双原子而不是单原子分子的形式存在。
观察氦时,该原子在每个 1 价壳层中拥有两个电子。 当两个原子轨道走到一起时,它们首先用两个电子填充成键轨道,但与氢不同的是,它还剩下两个电子,然后必须进入反键轨道。 反键轨道的不稳定性抵消了键轨道提供的稳定作用; 因此,双氦的键序为 0。这就是为什么氦更喜欢单原子而不是双原子。
多原子分子
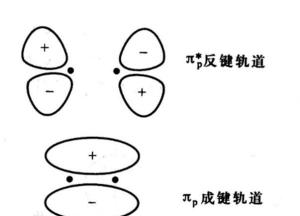
编辑pi键的键合MO
编辑Pi键是由轨道的“侧面”相互作用产生的。 再一次,在分子轨道中,当两个 π 原子轨道的相互作用同相时,会发生键合 pi (π) 电子。 在这种情况下,π 轨道的电子密度需要沿镜面对称,以产生键合相互作用。 沿镜像平面的不对称性将导致该平面中的节点,并在反键合轨道 π* 中描述。
简单共轭 π 系统的 MO 的一个例子是丁二烯。 要为丁二烯创建 MO,先前描述的系统的所得 π 和 π* 轨道将相互作用。 这种混合将产生 4 组轨道(也可用于描述任何二烯的 π MO):π1 不包含垂直节点,π2 包含一个,并且都被认为是成键轨道; π3 包含 2 个垂直节点,π4 包含 3 个并且都被认为是反键轨道。
局部分子轨道
编辑s 轨道的球形 3D 形状在空间中没有方向性,px、py 和 pz 轨道相互之间都是 90o。 因此,为了获得化学键对应的轨道来描述化学反应,Edmiston 和 Ruedenberg 率先开发了定位程序。 例如,在 CH4 中,来自氢原子 1s 轨道的四个电子和来自碳原子的价电子(s 中的 2 个和 p 中的 2 个)占据键合分子轨道 σ 和 π。
然后可以将甲烷分子中碳原子的离域 MO 局域化,得到四个 SP3 杂化轨道。
应用
编辑分子轨道,更具体地说,键合轨道是一种在化学的所有不同领域中教授的理论,从有机到物理甚至分析,因为它具有广泛的适用性。 有机化学家在他们的反应思想原理中使用分子轨道理论; 分析化学家在不同的光谱方法中使用它; 物理化学家在计算中使用它; 它甚至可以通过能带理论(分子轨道理论的延伸)在材料化学中看到。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214650/
