杂化轨道
编辑在化学中,轨道杂化(或杂化)是混合原子轨道形成新的杂化轨道(具有不同的能量、形状等,与组分原子轨道不同)的概念,适用于电子配对以形成价键中的化学键 理论。 例如,在一个形成四个单键的碳原子中,价壳 s 轨道与三个价壳 p 轨道结合,形成四个等价的 SP3 混合物,以围绕碳的四面体排列与四个不同的原子键合。 杂化轨道可用于解释分子几何形状和原子键合特性,并且在空间中对称分布。 通常杂化轨道是通过混合具有可比能量的原子轨道形成的。
历史和用途
编辑化学家 Linus Pauling 于 1931 年首次提出杂交理论,以使用原子轨道解释甲烷 (CH4) 等简单分子的结构。 鲍林指出,碳原子通过使用一个 s 轨道和三个 p 轨道形成四个键,因此可以推断碳原子将以直角(使用 p 轨道)形成三个键,并使用 s 轨道形成第四个较弱的键 在某个任意方向。 实际上,甲烷有四个强度相等的 C-H 键。 任意两个键之间的角度为四面体键角109°28’(约109.5°)。 鲍林假设在四个氢原子存在的情况下,s 和 p 轨道形成四种等效组合,他称之为杂化轨道。 每个杂化物都表示为 sp3 以指示其组成,并沿着四个 C-H 键之一定向。 这个概念是为这种简单的化学系统开发的,但这种方法后来得到了更广泛的应用,今天它被认为是一种有效的有机化合物结构合理化启发式方法。 它给出了一个简单的轨道图,相当于路易斯结构。
杂交理论是有机化学不可或缺的一部分,最引人注目的例子之一是。 为了绘制反应机制,有时需要两个原子共享两个电子的经典键合图。 杂交理论解释了烯烃和甲烷中的键合。 主要由轨道杂交决定的 p 特征或 s 特征的数量可用于可靠地预测分子性质,例如酸度或碱度。
概览
编辑轨道是分子内电子行为的模型表示。 在简单杂交的情况下,这种近似基于原子轨道,类似于氢原子的轨道,氢原子是唯一可以精确求解薛定谔方程的中性原子。 在碳、氮和氧等较重的原子中,使用的原子轨道是 2s 和 2p 轨道,类似于氢的激发态轨道。
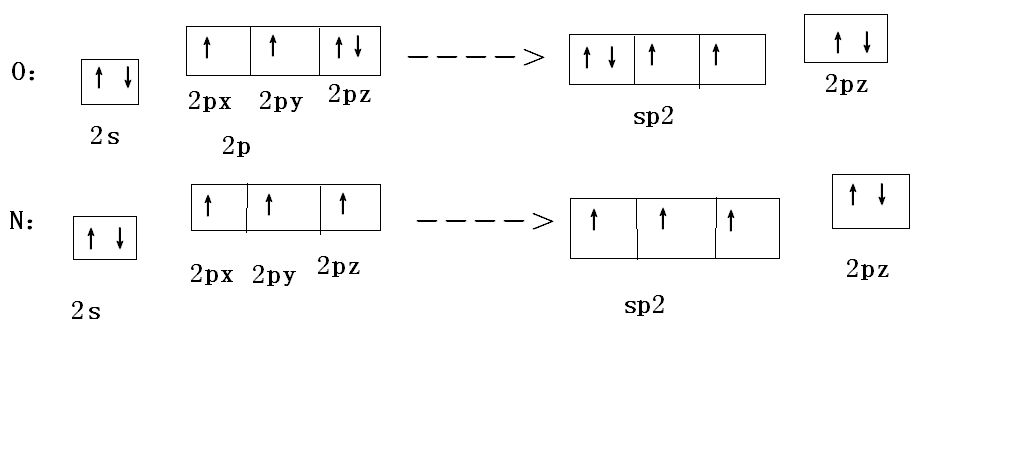
假设杂化轨道是原子轨道的混合物,以不同的比例相互叠加。 例如,在甲烷中,形成每个碳氢键的 C 杂化轨道由 25% 的 s 特征和 75% 的 p 特征组成,因此被描述为 sp3(读作 s-p-三)杂化。 量子力学将这种混合描述为 N ( s + 3 p σ ) {dISPlaystyle N(s+{sqrt {3}}psigma )} 形式的 sp3 波函数,其中 N 是归一化常数(此处 1/2) 和 pσ 是沿 C-H 轴定向的 p 轨道以形成 sigma 键。 在这个例子中,系数的比率(通常表示为 λ)是 3 {displaystyle color {blue}{sqrt {3}}}。 由于与轨道相关的电子密度与波函数的平方成正比,因此 p 特性与 s 特性的比率为 λ2 = 3。p 特性或 p 分量的权重为 N2λ2 = 3/4。
杂交类型
编辑sp3
编辑杂交从原子的角度描述了原子的键合。 对于四面体配位的碳(例如,甲烷 CH4),碳应具有 4 个具有正确对称性的轨道以与 4 个氢原子键合。
碳的基态配置为 1s2 2s2 2p2 或更容易阅读:
碳原子可以利用其两个单独占据的 p 型轨道与两个氢原子形成两个共价键,产生单线态亚甲基 CH2,这是最简单的卡宾。 碳原子也可以通过一个电子从双占据的 2s 轨道到空的 2p 轨道的激发(或促进)与四个氢原子键合,从而产生四个单独占据的轨道。
两个附加键的形成所释放的能量足以补偿所需的激发能,有力地促进了四个 C-H 键的形成。
量子力学上,如果四个键是等价的,则获得最低能量,这要求它们由碳上的等价轨道形成。 可以获得一组四个等效轨道,它们是价壳层(核心轨道几乎从不参与成键)s 和 p 波的线性组合。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214744/
