三中心四电子键
编辑三中心四电子 (3c–4e) 键是一种模型,用于解释某些高价分子中的键合,例如四原子和六原子卤间化合物、四氟化硫、氟化氙和氟化氢离子。
根据乔治·皮门特尔 (George C. Pimentel) 于 1951 年发表的作品,它也被称为皮门特尔-朗德尔 (Pimentel-Rundle) 三中心模型,该模型建立在罗伯特·朗德尔 (RoBERT E. Rundle) 早期为缺电子键合开发的概念之上。
该模型的扩展版本用于描述整个类别的高价分子,如五氟化磷和六氟化硫,以及多中心 π 键,如臭氧和三氧化硫。
还有乙硼烷(B2H6)、二氢乙烷(Al2H6)等具有三中心双电子键(3c-2e)键的分子。
历史
编辑虽然路易斯 (Lewis) 支持扩展八位组的观点,调用 s-p-d 杂化轨道并保持 2c-2e 相邻原子之间的键,朗格缪尔 (<SPan style=”color: #262626;font-family: var(–theme-font-family)”>Langmuir) 相反选择维持八位组规则,调用超价化合物中键合的离子基础(参见超价分子,PF5 和 SF6 的价键理论图)。
在 1951 年的开创性论文中,皮门特尔 (Pimentel) 合理化了高价三卤化物离子中的键合 (X−3, X = F, Br, Cl, I) 通过分子轨道 (MO) 描述,建立在 1947 年朗德尔 (Rundle) 引入的半键概念的基础上。
在这个模型中,四个电子中的两个占据全同相键合 MO,而另外两个占据非键合 MO,导致相邻原子之间的总键序为 0.5(参见分子轨道描述)。
最近对超价分子的理论研究支持朗格缪尔 (Langmuir) 的观点,证实八位组规则是描述 s- 和 p- 块元素中键合的良好第 一近似。
三中心四电子键合分子实例
编辑σ 3c–4e
π 3c–4e
结构与键合
编辑分子轨道描述
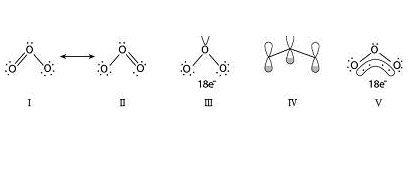
三碘化物的 σ 分子轨道 (MOs) 可以通过考虑中心原子的 p 轨道(与键轴共线)与外 围原子的 p 轨道的同相和异相组合来构建。三个分子轨道由三个相关原子轨道的组合产生,四个电子占据能量最低的两个 MO——键合 MO 在所有三个中心离域,非键合 MO 位于外 围中心。
使用此模型,可以避免在中心原子处调用超价键合考虑因素,因为键合轨道实际上由两个 2-center-1-electron 键(它们一起不违反八位组规则)和其他两个电子组成 占据非键合轨道。
价键(自然键轨道)描述
在 3c-4e 键合的自然键轨道观点中,三碘化物阴离子由二碘 (I2) σ 分子轨道和碘化物 (I−) 孤对电子的组合构成。I− 孤对电子充当双电子供体,而 I2 σ* 反键轨道充当双电子受体。将供体和受体以同相和异相组合的方式组合。
结合供体孤对与受体 σ* 反键合轨道导致最高占据轨道 (ψ2) 的整体能量降低。描绘的图表将右侧原子显示为供体,但可以使用左侧原子作为供体来构建等效图。
该键合方案通过以下两个共振结构简洁地总结:其目的仅是表示连通性,当取平均值时,它再现了从自然键轨道分析和分子轨道理论中获得的 0.5 的 I-I 键阶。
最近的理论研究表明存在一种新型的供体-受体相互作用,这种相互作用可能在具有所谓的反转电负性的三原子物种中占主导地位;也就是说,中心原子比外 围原子更具电负性的情况。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214777/
