简介
编辑在化学和物理学中,活化能是化合物发生化学反应所必须提供的最小能量。 反应的活化能 (Ea) 以焦耳每摩尔 (J/mol)、千焦每摩尔 (kJ/mol) 或千卡每摩尔 (kcal/mol) 为单位测量。 活化能可以被认为是势垒(有时称为能垒)的大小,它分隔与初始和最终热力学状态有关的势能面的最小值。 为了使化学反应以合理的速度进行,系统的温度应该足够高,以便存在相当数量的分子,其平动能等于或大于活化能。
其他用途
编辑虽然不太常用,但活化能也适用于核反应和各种其他物理现象。
温度依赖性和与阿伦尼乌斯方程的关系
编辑Arrhenius 方程给出了活化能与反应进行速率之间关系的定量基础。 从等式中,激活能量可以通过关系 k = A e − E a / ( R T ) {dISPlaystyle k=Ae{{-E_{TeXtrm {a}}}/{(RT)} }}
其中 A 是反应的指前因子,R 是通用气体常数,T 是绝对温度(通常以开尔文为单位),k 是反应速率系数。 即使不知道 A,Ea 也可以根据作为温度函数的反应速率系数的变化进行评估(在 Arrhenius 方程的有效性范围内)。
在更高级的层面上,Arrhenius 方程中的净 Arrhenius 活化能项最好被视为实验确定的参数,它表明反应速率对温度的敏感性。 将这种活化能与基本反应的阈值势垒联系起来有两个反对意见。 首先,反应是否在一个步骤中进行通常是不清楚的; 在所有基本步骤上平均得出的阈值障碍几乎没有理论价值。 其次,即使所研究的反应是基本反应,一系列单独的碰撞也有助于从涉及数十亿分子的大量(“灯泡”)实验中获得速率常数,具有许多不同的反应物碰撞几何形状和角度,不同的平移和(可能 ) 振动能量——所有这些都可能导致不同的微观反应速率。
催化剂
编辑改变过渡态以降低活化能的物质称为催化剂; 仅由蛋白质和(如果适用)小分子辅助因子组成的催化剂称为酶。 催化剂提高反应速率而不在反应中被消耗。 此外,催化剂降低了活化能,但不会改变原始反应物或产物的能量,因此不会改变平衡。 相反,反应物能量和产物能量保持不变,只有活化能改变(降低)。
催化剂能够通过以更有利的方式形成过渡态来降低活化能。 从本质上讲,催化剂可以更舒适地适应反应的底物,从而进展到过渡态。 这是可能的,因为当底物与催化剂的活性位点结合时会释放能量。 这种能量被称为结合能。 在与催化剂结合后,底物在活性位点内参与许多稳定力(例如氢键或范德华力)。 在活性位点内发生特定且有利的键合,直到底物形成成为高能过渡态。 形成过渡态对催化剂更有利,因为活性位点内有利的稳定相互作用释放能量。
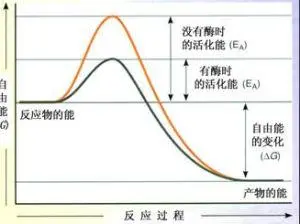
当催化剂的活性位点内存在稳定配合时,化学反应能够更容易地制造高能过渡态分子。 反应的结合能是当底物和催化剂之间发生有利的相互作用时释放的能量。 释放的结合能有助于实现不稳定的过渡态。 没有催化剂的反应需要更高的能量输入才能达到过渡态。 非催化反应不具有可从活性位点稳定相互作用(例如催化酶反应)获得的自由能。
与吉布斯活化能的关系
编辑在阿伦尼乌斯方程中,激活能(Ea)项用于描述达到过渡态所需的能量,指数关系k = A exp(−Ea/RT)成立。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/215917/
