酸碱质子理论
编辑该理论的基本概念是当一种酸和一种 碱相互反应,酸形成共轭碱,碱通过交换质子(氢阳离子,或 H+)形成共轭酸。 该理论是阿伦尼乌斯理论的推广。
酸和碱的定义
编辑在 Arrhenius 理论中,酸被定义为在水溶液中解离产生 H+(氢离子)的物质,而碱被定义为在水溶液中解离产生 OH-(氢氧根离子)的物质。
1923 年,丹麦的物理化学家 Johannes Nicolaus Brønsted 和英国的 Thomas Martin Lowry 都独立提出了以他们名字命名的理论。 在 Brønsted–Lowry 理论中,酸和碱是根据它们彼此反应的方式来定义的,这具有更大的普遍性。 该定义以平衡表达式表示
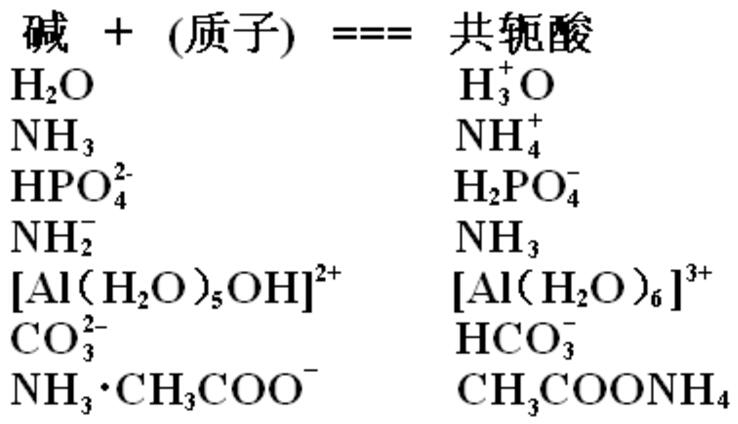
酸+碱⇌共轭碱+共轭酸。
使用平衡符号 ⇌ 是因为反应可以向前和向后两个方向发生。 酸 HA 可以失去一个质子,变成它的共轭碱基 A−。 碱基 B 可以接受质子成为其共轭酸 HB+。 大多数酸碱反应速度很快,因此反应的成分之间通常处于动态平衡状态。
水溶液
编辑酸碱反应的逆反应也是酸碱反应,在第一个反应中碱的共轭酸和酸的共轭碱之间。 在上面的例子中,醋酸盐是逆反应的碱,水合氢离子是酸。
Brønsted-Lowry 理论与 Arrhenius 理论相比的一个标志是它不需要酸来解离。
两性物质
编辑Brønsted-Lowry 理论的本质是酸仅在与碱相关时存在,反之亦然。 水是两性的,因为它可以充当酸或碱。一个 H2O 分子作为碱基并获得 H+ 成为 H3O+,而另一个 充当酸并失去 H+ 变成 OH−。
另一个例子是由氢氧化铝、Al(OH)3 等物质提供的。
非水溶液
编辑氢离子或水合氢离子在水溶液中是一种布朗斯台德-洛瑞酸,而氢氧根离子是一种碱,由于自离解反应
H 2 O + H 2 O ↽ − ⇀ H 3 O + + OH − {dISPlaystyle {ce {H2O + H2O <=>; H3O+ + OH-}}}
类似的反应发生在液氨中
NH 3 + NH 3 ↽ − ⇀ NH 4 + + NH 2 − {diSPlaystyle {ce {NH3 + NH3 <=>; NH4+ + NH2-}}}
因此,铵离子 NH+4 在液氨中的作用与水合氢离子在水中的作用相同,而酰胺离子 NH-2 类似于氢氧根离子。 铵盐表现为酸,而酰胺表现为碱。
一些非水溶剂可以作为碱,即质子受体,与 Brønsted–Lowry 酸相关。
其中 S 代表溶剂分子。 最重要的此类溶剂是二甲亚砜、DMSO 和乙腈、CH3CN,因为这些溶剂已广泛用于测量有机分子的酸离解常数。 因为 DMSO 是比 H2O 更强的质子受体,所以酸在该溶剂中变成比在水中更强的酸。 实际上,许多分子在非水溶液中表现为酸
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/216052/
