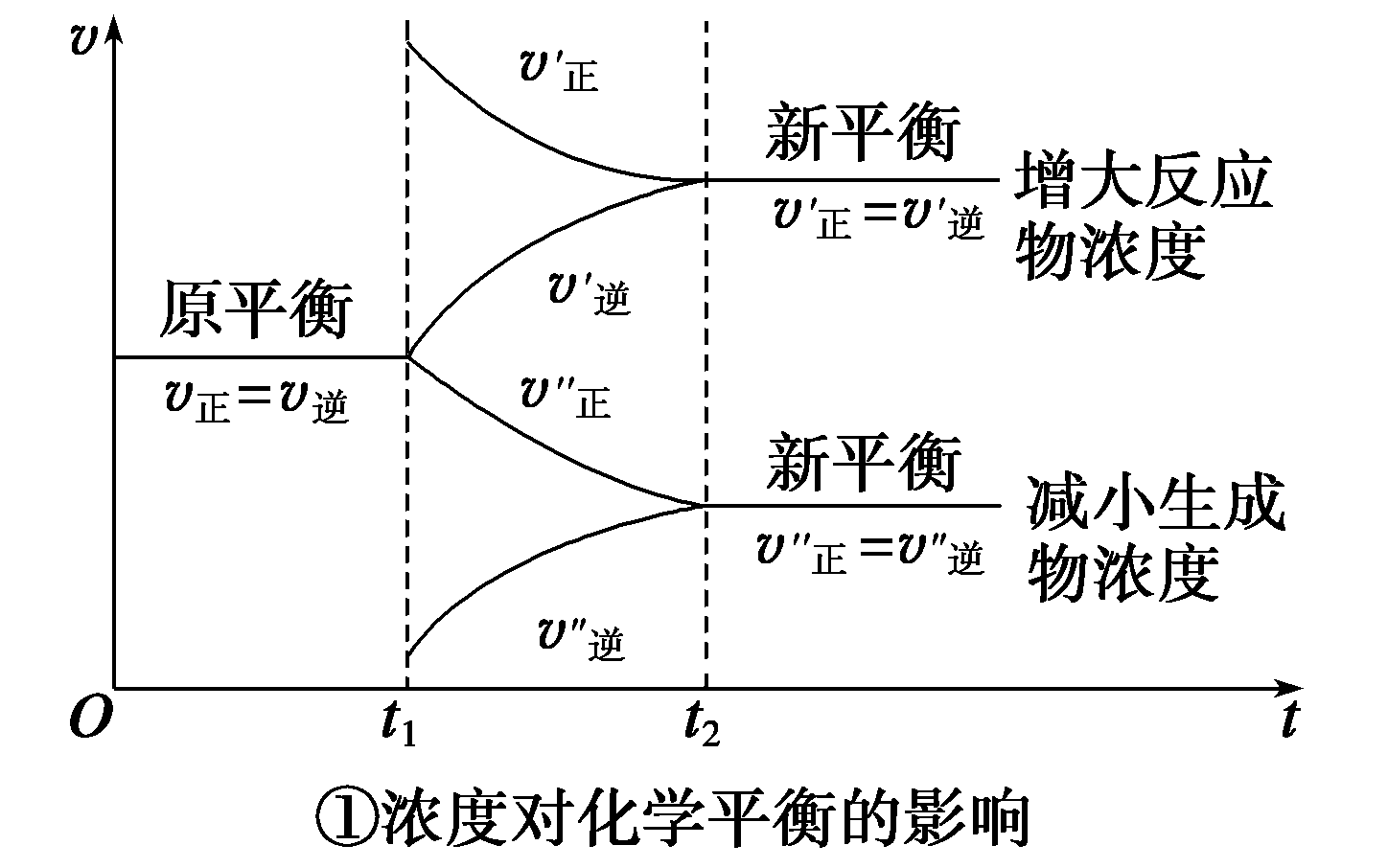
动态平衡
编辑在化学中,一旦发生可逆反应,就存在动态平衡。 物质以相同的速率在反应物和产物之间转换,这意味着没有净变化。 反应物和产物的形成速度使得两者的浓度都不会改变。 它是处于稳定状态的系统的一个特例。
在物理学中,关于热力学,当反应以混合物的组成不随时间变化的速率发生时,封闭系统处于热力学平衡。 事实上确实会发生反应,有时反应非常剧烈,但反应的程度无法观察到成分的变化。 平衡常数可以用可逆反应的速率常数来表示。
例子
编辑在一瓶新苏打水中,液相中二氧化碳的浓度具有特定值。 如果倒出一半液体并密封瓶子,二氧化碳将以不断降低的速度离开液相,而气相中二氧化碳的分压将增加,直至达到平衡。 此时,由于热运动,一个 CO2 分子可能离开液相,但在很短的时间内,另一个 CO2 分子将从气体转移到液体,反之亦然。 在平衡状态下,CO2 从气相转移到液相的速率等于从液相转移到气相的速率。 在这种情况下,液体中 CO2 的平衡浓度由亨利定律给出,该定律指出气体在液体中的溶解度与该气体在液体上方的分压成正比。 这种关系被写成
c = K P {dISPlaystyle c=KP}
其中 K 是与温度相关的常数,P 是分压,c 是液体中溶解气体的浓度。 因此,气体中 CO2 的分压会增加,直到满足亨利定律。 液体中二氧化碳的浓度降低了,饮料也失去了一些嘶嘶声。
亨利定律可以通过将两相中二氧化碳的化学势设定为彼此相等来导出。 化学势相等定义化学平衡。 涉及相变的动态平衡的其他常数包括分配系数和溶度积。 拉乌尔定律定义了理想溶液的平衡蒸气压
动态平衡也可以存在于单相系统中。 一个简单的例子发生在酸碱平衡中,例如乙酸在水溶液中的解离。
在这种情况下,正向反应涉及从乙酸分子中释放一些质子,而反向反应涉及当乙酸根离子接受质子时形成乙酸分子。 当平衡表达式左侧的物质的化学势之和等于右侧物质的化学势之和时,达到平衡。 同时,正向反应和反向反应的速率彼此相等。 涉及化学复合物形成的平衡也是动态平衡,浓度由复合物的稳定常数决定。
动态平衡也可以发生在气相中,例如当二氧化氮二聚时。
在气相中,方括号表示分压。 或者,物质的分压可以写成 P(物质)。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/216061/
