哈米特酸度数
编辑哈米特酸度数 (H0) 是酸度的量度,用于非常浓的强酸溶液,包括超强酸。 它由物理有机化学家 Louis Plack Hammett 提出,是最著名的酸度函数,用于将 Brønsted-Lowry 酸度的测量扩展到 pH 标度有用的稀水溶液之外。
在高度浓缩的溶液中,由于活度系数的变化,简单的近似值(例如 Henderson–Hasselbalch 方程)不再有效。 哈米特酸度数用于研究酸催化反应的物理有机化学等领域,因为其中一些反应使用的酸浓度非常高,甚至是纯酸。
定义
编辑哈米特酸度函数 H0 可以代替浓溶液中的 pH 值。
其中 log(x) 是 x 的常用对数,pKBH+ 是 BH+ 解离度的 −log(K),BH+ 是非常弱的碱基 B 的共轭酸,具有非常负的 pKBH+。 这样,就好像 pH 范围已扩展到非常负的值。 Hammett 最初使用一系列带有吸电子基团的苯胺作为碱基。
其中 a 是活度,γ 是热力学活度系数。 在稀水溶液 (pH 0–14) 中,主要的酸种类是 H3O+,活度系数接近于一,因此 H0 大约等于 pH。 然而,超出此 pH 范围,有效氢离子活性的变化比浓度快得多。 这通常是由于酸性物质的性质发生了变化; 例如,在浓硫酸中,主要的酸种类 (H+) 不是 H3O+,而是 H3SO4+,后者是一种强得多的酸。 纯硫酸的 H0 = -12 值不能解释为 pH = −12(这意味着理想溶液中的 H3O+ 浓度不可能高到 10+12 mol/L)。 相反,这意味着存在的酸物质 (H3SO4+) 在虚构(理想)浓度为 1012 mol/L 时具有与 H3O+ 等效的质子化能力,这是通过其质子化弱碱的能力来衡量的。
虽然哈米特酸度函数是最著名的酸度函数,但其他酸度函数已由 Arnett、Cox、Katrizky、Yates 和 Stevens 等作者开发。
典型值
编辑在这个尺度上,纯 H2SO4 (18.4 M) 的 H0 值为 -12,而焦硫酸的 H0 ~ -15。 请注意,哈米特酸度数显然在其方程式中避免了水。 它是 pH 标度的概括——在稀水溶液(其中 B 是 H2O)中,pH 值非常接近于 H0。 通过使用与溶剂无关的酸度定量测量,消除了平衡效应的影响,并且可以直接比较不同物质的酸度(例如,使用 pKa,HF 在水中弱于 HCl 或 H2SO4 但强于 HCl 在冰醋酸中。)
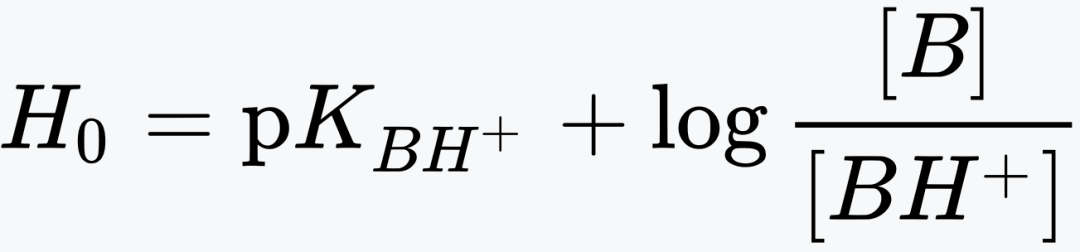
某些浓酸的 H0:
- 氦元素:-63
- 氟锑酸 (1990):-23 < H0< −21
- 魔酸 (1974):-19.2
- 碳硼烷超强酸:H0 <; −18.0
- 氟磺酸 (1944):-15.1
- 氟化氢:-15.1
- 三氟甲磺酸 (1940):-14.1
- 高氯酸:-13
- 氯化磺酸:-13.8; −12.78
- 硫酸:-12.0
对于混合物(例如,在水中部分稀释的酸),酸度函数取决于混合物的组成,必须根据经验确定。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/216174/
