绝热不变量
编辑物理系统的一种属性,例如气体的熵,在缓慢发生变化时保持近似恒定,称为绝热不变量。 这意味着如果系统在两个端点之间变化,随着端点之间变化的时间增加到无穷大,两个端点之间的绝热不变量的变化变为零。
在热力学中,绝热过程是在没有热流的情况下发生的变化。 它可能会很慢或很快。 可逆绝热过程是与达到平衡的时间相比缓慢发生的绝热过程。 在可逆绝热过程中,系统在所有阶段都处于平衡状态,并且熵是恒定的。 在 20 世纪上半叶,从事量子物理学研究的科学家使用术语绝热来表示可逆的绝热过程,后来用于任何允许系统调整其配置的逐渐变化的条件。 量子力学的定义更接近准静态过程的热力学概念,与热力学中的绝热过程没有直接关系。
在力学中,绝热变化是哈密顿量的缓慢变形,其中能量的分数变化率比轨道频率慢得多。 相空间中不同运动所围成的区域是绝热不变量。
在量子力学中,绝热变化是以比能量本征态之间的频率差慢得多的速率发生的变化。 在这种情况下,系统的能态不发生跃迁,因此量子数是绝热不变量。
旧的量子理论是通过使系统的量子数与其经典绝热不变量相等来制定的。 这就决定了玻尔-索末菲量子化规则的形式:量子数是经典轨道相空间中的面积。
热力学
编辑在热力学中,绝热变化是指不增加熵的变化。 与感兴趣的系统的其他特征时间尺度相比,它们发生得很慢,并且只允许相同温度的物体之间的热流动。 对于孤立系统,绝热变化不允许热量流入或流出。
理想气体的绝热膨胀
编辑如果装有理想气体的容器瞬间膨胀,则气体的温度根本不会改变,因为没有分子减速。 分子保持动能,但现在气体占据了更大的体积。 然而,如果容器膨胀缓慢,理想气压定律在任何时候都成立,气体分子失去能量的速度与它们在膨胀壁上做功的速度相同。 他们所做的工作量是压力乘以壁面积乘以向外位移,
如果没有热量进入气体,则气体分子中的能量会减少相同的量。 根据定义,当气体的温度仅与每个粒子的内能而非体积有关时,气体就是理想气体。 所以
d T = 1 N C v d E {dISPlaystyle dT={1 over NC_{v}}dE}
其中 C v {diSPlaystyle C_{v}} 是定容比热。 当能量的变化完全是由于在墙上所做的功时,
这给出了温度和体积变化之间的微分关系,可以对其进行积分以找到不变量。 常数 k B {displaystyle k_{B}} 只是一个单位换算因子,
所以熵是绝热不变量。 N log(N) 项使熵相加,因此两体积气体的熵是每一体积的熵之和。
在分子解释中,S 是具有能量 E(T) 和体积 V 的所有气体状态的相空间体积的对数。
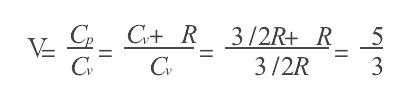
对于单原子理想气体,可以通过记下能量轻松看出这一点,
E = 1 2 m ∑ k p k 1 2 + p k 2 2 + p k 3 2
总能量为 E 的气体的不同内部运动定义了一个球体,即半径为 2 m E 的 3N 维球的表面。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/216338/
