构象异构
编辑在化学中,构象异构现象是立体异构现象的一种形式,其中异构体可以仅通过形式上单键的旋转而相互转换(参见单键旋转图)。 虽然分子中原子的任意两种排列因单键旋转而不同,可称为不同的构象,但对应于势能面上局部最小值的构象特别称为构象异构体或构象异构体。 对应于能量面上局部最大值的构象是局部最小构象异构体之间的过渡态。 围绕单键的旋转涉及克服旋转能垒以将一种构象异构体相互转化为另一种构象异构体。 如果能垒低,则存在自由旋转,并且化合物样品以多种构象异构体的快速平衡混合物形式存在; 如果能垒足够高,则旋转受限,则分子可能作为稳定的旋转异构体或旋转异构体(由受阻单键旋转产生的异构体)存在相对较长的时间。 当相互转化的时间尺度足够长以分离单个旋转异构体时(通常任意定义为 1000 秒或更长的相互转化半衰期),异构体被称为阻转异构体(参见:阻转异构现象)。 取代环己烷的倒环构成了另一种常见的构象异构形式。
因此,构象异构体不同于其他类别的立体异构体(即构型异构体),其中相互转化必然涉及化学键的断裂和重组。 例如,有机分子的 L/D- 和 R/S- 构型具有不同的手性和旋光性,只能通过断开与手性原子相连的一个或多个键并在不同的方向或空间重新形成相似的键来实现相互转换 方向。 它们也不同于几何(顺式/反式)异构体,这是另一类立体异构体,后者需要双键的 π 组分断裂才能相互转化。 (虽然区别并不总是很明确,因为某些形式上为单键的键实际上具有双键特征,只有在考虑二次共振贡献者时才会变得明显,例如酰胺的 C-N 键。)由于 由于快速相互转换,构象异构体通常在室温下不可分离。
研究不同构象之间的能量学称为构象分析。 它有助于理解不同异构体的稳定性,例如,通过考虑取代基的空间取向和空间相互作用。 此外,构象分析可用于预测和解释产品选择性、机制和反应速率。 构象分析在基于结构的合理药物设计中也起着重要作用。
类型
编辑旋转碳-碳键,乙烷和丙烷分子具有三个局部能量最小值。 它们在结构和能量上是等价的,被称为交错构象。 对于每个分子,从每个碳-碳键发出的三个取代基是交错的,每个 H-C-C-H 二面角(以及丙烷情况下的 H-C-C-CH3 二面角)等于 60°( 或在丙烷的情况下大约等于 60°)。 二面角为零的三个重叠构象是连接两个等效能量最小值的过渡态(能量最大值),即交错构象异构体。
丁烷分子是最简单的分子,其单键旋转会产生两种类型的非等价结构,称为反构象和反构象。
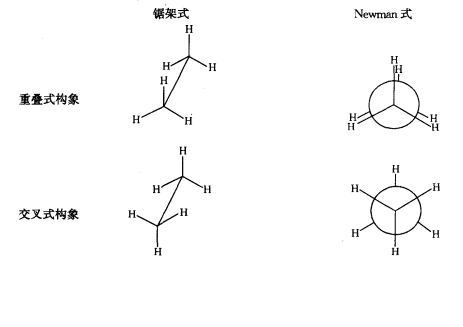
例如,丁烷具有三个与其两个甲基 (CH3) 基团相关的构象异构体:两个左旋构象异构体,其甲基相距 ±60° 并且是对映体,以及一个反构象异构体,其中四个碳中心共面且取代基为 180 °分开(参考丁烷的自由能图)。 gauche 和 anti 之间的能量差为 0.9 kcal/mol,这与 gauche 构象异构体的应变能有关。 因此,反构象异构体是最稳定的 (≈ 0 kcal/mol)。 二面角分别为 0°、120° 和 240° 的三个重叠构象是构象异构体之间的过渡态。 请注意,两个重叠的构象具有不同的能量:在 0° 时,两个甲基被重叠,导致比在 120° 时更高的能量 (≈ 5 kcal/mol),其中甲基与氢重叠 (≈ 3.5 kcal/mol) ).
虽然简单的分子可以用这些类型的构象来描述,但更复杂的分子需要使用 Klyne-Prelog 系统来描述不同的构象异构体。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/220331/
