组蛋白甲基化
编辑组蛋白白甲基化是一个过程,通过该过程,甲基被转移到构成核小体的组蛋白的氨基酸上,DNA 双螺旋缠绕核小体形成染色体。 组蛋白的甲基化可以增加或减少基因的转录,这取决于组蛋白中的哪些氨基酸被甲基化,以及连接了多少甲基。 削弱组蛋白尾部和 DNA 之间化学吸引力的甲基化事件增加了转录,因为它们使 DNA 从核小体上解开,以便转录因子蛋白和 RNA 聚合酶可以访问 DNA。 这个过程对于允许不同细胞表达不同基因的基因表达调节至关重要。
函数
编辑组蛋白甲基化作为一种修饰染色质结构的机制,与已知对形成长期记忆和学习很重要的神经通路的刺激有关。 动物模型显示甲基化和其他表观遗传调控机制与衰老、神经退行性疾病和智力障碍相关。 H3K4、H3K27 和 H4K20 的失调与癌症有关。 这种修饰改变了核小体的特性并影响其与其他蛋白质的相互作用,特别是在基因转录过程方面。
- 组蛋白甲基化可与转录抑制或激活相关。 例如,组蛋白 H3 在赖氨酸 4 (H3K4me3) 的三甲基化是转录的活性标记,并且在大鼠的情境恐惧条件反射后一小时在海马体中上调。
- 组蛋白的一些赖氨酸 (K) 和精氨酸 (R) 残基的甲基化导致转录激活。 示例包括组蛋白 3 (H3K4me1) 的赖氨酸 4 以及 H3 和 H4 上的精氨酸 (R) 残基的甲基化。
- 通过组蛋白甲基转移酶向组蛋白添加甲基,可以激活或进一步抑制转录,这取决于被甲基化的氨基酸以及附近是否存在其他甲基或乙酰基。
机制
编辑染色质的基本单位称为核小体,包含缠绕在蛋白质八聚体周围的 DNA。 该八聚体由四种组蛋白各有两个拷贝组成:H2A、H2B、H3 和 H4。 这些蛋白质中的每一个都有尾部延伸,这些尾巴是通过甲基化进行核小体修饰的目标。 DNA 的激活或失活在很大程度上取决于甲基化的特定尾部残基及其甲基化程度。 组蛋白只能在赖氨酸 (K) 和精氨酸 (R) 残基上发生甲基化,但甲基化最常见于组蛋白尾部 H3 和 H4 的赖氨酸残基。 离核小体核心最远的尾端是 N 端(残基从这一端开始编号)。 与基因激活相关的常见甲基化位点包括 H3K4、H3K48 和 H3K79。 基因失活的常见位点包括 H3K9 和 H3K27。 对这些位点的研究发现,组蛋白尾部不同残基的甲基化可作为招募各种蛋白质或蛋白质复合物的标记,这些蛋白质或蛋白质复合物用于调节染色质激活或失活。
赖氨酸和精氨酸残基均含有氨基,赋予碱性和疏水特性。 赖氨酸能够被单甲基化、二甲基化或三甲基化,甲基取代其 NH3+ 基团中的每个氢。 有了游离的 NH2 和 NH2+ 基团,精氨酸能够被单甲基化或二甲基化。 这种二甲基化可以不对称地发生在 NH2 基团上,也可以对称地发生在每个基团上一个甲基化。 在每个残基上每次添加甲基都需要一组特定的蛋白酶以及各种底物和辅助因子。 通常,精氨酸残基的甲基化需要包括蛋白质精氨酸甲基转移酶 (PRMT) 在内的复合物,而赖氨酸需要特定的组蛋白甲基转移酶 (HMT),通常包含进化上保守的 SET 结构域。
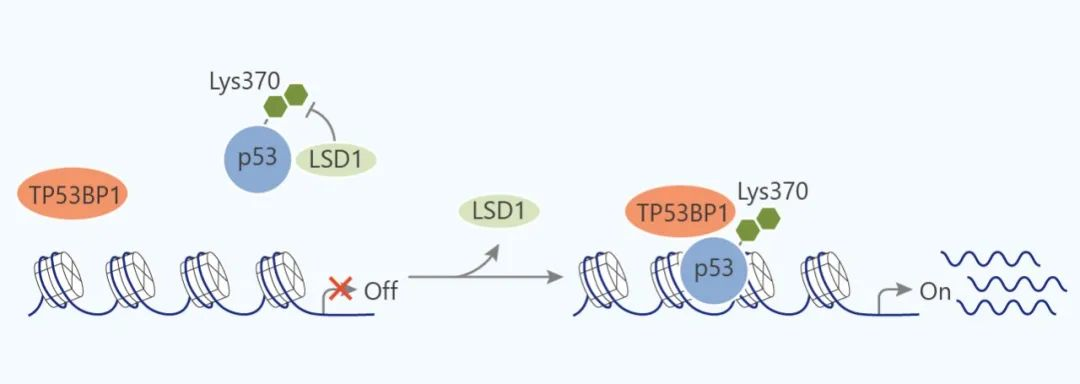
不同程度的残基甲基化可以赋予不同的功能,例如通常研究的 H4K20 残基的甲基化。 单甲基化 H4K20 (H4K20me1) 参与染色质的压实,因此参与转录抑制。 然而,H4K20me2 在修复受损 DNA 中至关重要。 当二甲基化时,残基为参与通过非同源末端连接修复双链 DNA 断裂的蛋白质 53BP1 的结合提供平台。 观察到 H4K20me3 集中在异染色质中,并且在癌症进展中观察到这种三甲基化的减少。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/250166/
