沸点
编辑纯物质的沸点,是其相图中的一对值,由两个变量组成:饱和温度(特别是沸点温度)和气液相界处的饱和蒸气压(尤其是沸腾压力)。 它由物质从液态转变为气态聚集时的压力和温度这两个状态变量组成。在开放液体的情况下,沸点是温标上蒸气压等于的点大气压。
沸点表示物质从液态到气态的相变过程中存在的条件,称为沸腾。 此外,它与冷凝逆过程的冷凝点相同,但仅适用于纯物质。 当物质混合物蒸发时,沸腾行为发生变化,人们观察到沸点范围而不是单个沸点。 在沸点以下从液相到气相的相变称为蒸发。
在表中,沸腾温度是在常压下给出的,即在1013.25 HPa。这个沸点称为标准沸点,给出的沸点温度称为标准沸点(TSied)。 一种估算方法是 Pailhes 方法,而 Guldberg 规则建立与临界温度沸点的联系将减少到只有一对值,因此在形式上是不正确的。
例如,对于高压锅,您可以利用沸腾温度和沸腾压力相互依赖的事实。 通常通过将压力增加 1 bar (1000 hPa),水的沸腾温度可以从 100 °C 增加到 120 °C 左右。 这两个温度都代表沸腾温度,但只有 100 °C 的值也是常压下的沸腾温度,因此是正常沸腾温度。 因此,这两个术语的混合是不明确的,绝不是不言而喻的,应该避免。
煮沸过程
编辑在沸点以下和以上,液体或气体的加热只会导致温度升高。 所提供的能量被转化为粒子的动能。 然而,在从液体到气体的相变过程中,只要压力也保持不变,温度就会保持不变。 所有提供的热能都投入到状态的变化中。
一旦达到沸点,当提供更多能量时,颗粒之间的化学-物理相互作用就会溶解 – 颗粒进入气相。 液体的温度停滞是因为所提供的热能完全用于破坏分子间键。 一摩尔物质所需要的能量也称为摩尔汽化焓,与物质的量无关的能量称为汽化焓。 只有当所有颗粒都处于气相时,系统的温度才会再次升高。
没有灰尘颗粒或气泡的水、过氧化氢或碱性溶液(例如烧碱)也可以在干净的容器中加热到沸点以上而不沸腾。 导致混合的最小扰动,例如振动,可导致液体与气相的爆炸性分离,这被称为延迟沸腾。 为了避免这种情况,在化学工作过程中添加了倾向于延迟沸腾的液体,即所谓的由粘土或浮石制成的沸石,它们不受化学物质的侵蚀,但由于其多孔结构,有助于形成小气泡,因此不会发生沸腾延迟。
沸点曲线
编辑相图中气液相界线上的所有温度-压力值对共同形成沸点s曲线,其上存在热力学平衡。 沸点s曲线通常也称为沸腾曲线、沸腾线、沸点压力曲线或沸点曲线。 这条曲线由两点界定:
- 三重点 Pt:如果压力-温度值对低于三重温度或三重压力,则只有固态和气态之间的转变是可能的,即升华或再升华。
- 临界点Pc:压力-温度值对是否高于临界温度或临界压力下,液态和气态的密度不再有差异,这就是为什么它们不再被相界线分隔,处于这种状态的物质因此被称为超临界流体。
沸点s曲线的平衡是动态平衡。 颗粒不断地从液体中逸出进入气相——它们蒸发了。 另一方面,这些颗粒也重新进入液相——它们凝结。 离开液相的粒子数与重新进入液相的粒子数之比取决于温度和压力:温度越高,由于其速度越快而蒸发的粒子越多(参见麦克斯韦-玻尔兹曼分布)。 然而,蒸发的颗粒越多,蒸汽压越高,再次凝结的颗粒就越多。 当进入气相的颗粒与返回液相的颗粒一样多时,达到平衡。 由于在该状态下气相饱和,因此也称为饱和蒸气压。 从中定量导出沸点 s 曲线的热力学定律称为克劳修斯-克拉佩龙方程。 对于水,饱和蒸汽压和饱和温度之间的这种关系也可以使用 Magnus 公式类型的近似方程来确定。
以水为例的平衡变化
编辑示例性起点:在沸点 80 °C 和 474 hPa 压力下,水与其气相处于平衡状态:
H 2 O ( g ) ⇋ H 2 O ( l )
系统对各个状态变量变化的反应导致平衡位置的移动:逆转扰动的相变发生得更强烈(见最小约束原则)。
- 如果系统冷却到 70 °C,气相的蒸气压过高,水蒸气凝结,直到蒸气压达到新的平衡值 312 hPa 或没有气态水留下。
- 如果系统加热到 90°C,气相的蒸气压太低,水会蒸发,直到蒸气压达到新的平衡值 702 hPa 或没有液态水留下。
- 如果在温度保持不变的情况下将压力从 474 hPa 增加到 700 hPa,则气相的蒸气压过高,气态水会冷凝,直到蒸气压达到 474 hPa 的旧平衡值或没有剩下更多的水汽。
- 如果压力从 474 hPa 降低到 250 hPa 而温度保持不变,则气相的蒸气压太低并且水会蒸发,直到蒸气压达到 474 hPa 的旧平衡值或没有液态水就剩下了。
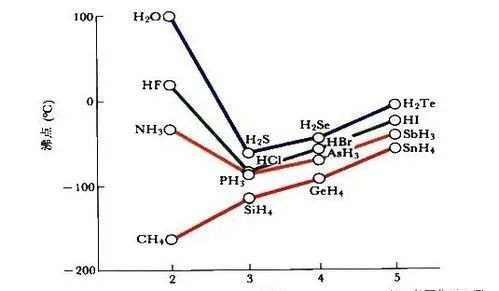
沸点的物质依赖性
编辑- 沸点取决于液相中最小颗粒之间的结合力的强度:结合力越强,沸点越高,因为必须首先克服这些。 如果比较 HF 和 HCl,这一点就会变得很清楚,例如:在液态氟化氢(沸点 20 °C)中,分子形成氢键,而在液态氯化氢(沸点 -85 °C)中,较弱的偶极-偶极相互作用占主导地位。 这同样适用于相对非常高的水沸点,当您将其与二氧化碳进行比较并考虑摩尔质量的影响时,这一点就会变得很清楚。
- 沸点对物质的摩尔质量或分子质量的依赖性至多起次要作用。 较大的摩尔质量通常与较高的浓度相关,例如由于相关体积。 然而,与通常声称的相反,摩尔质量对克服分子间吸引力所需的动能没有直接影响。 摩尔质量对分子间吸引力的直接影响很难反驳,因为其他影响因素很难排除。 实证结果表明影响很小。
它仍然用作估计沸点的简化指南。 观察到物质比具有更高摩尔质量的类似物质具有更高的沸点被称为沸点异常。伦敦色散相互作用甚至比偶极-偶极相互作用更弱。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/372910/
