磷氧化剂
编辑磷氧化剂(或磷酸)是任何其分子由磷、氧和氢原子组成的酸的总称。此类化合物的数量可能是无限的。其中一些是不稳定的,没有被分离出来,但衍生的阴离子和有机基团存在于稳定的盐和酯中。在生物学、地质学、工业和化学研究中最重要的是磷酸,其酯和盐是磷酸盐。一般来说,任何与氧原子结合的氢原子都是酸性的,这意味着-OH基团可以失去一个质子H+,留下一个带负电荷的-O-基团,从而使酸变成一个磷氧阴离子。每失去一个额外的质子都有一个相关的酸解离常数Ka1,KA2Ka3,…,通常用它的全称来表示(pKa1,pKa2,pKa3,…)。直接与磷结合的氢原子一般不呈酸性。
磷氧化剂的分类
编辑磷类氧化剂可按磷原子的氧化态分类,氧化态可从+1到+5不等。氧原子通常处于氧化态-2,但如果分子中包括过氧化物基团,则可能处于氧化态-1。氧化态+1过磷酸(或膦酸),H3PO2(或H2PO(OH)),是一种单质酸(意味着只有一个氢原子是酸性的)。它的盐和酯被称为次磷酸盐或磷酸盐。氧化态+3磷酸(或膦酸),H3PO3(或HPO(OH)2),一种二元酸(只有两个酸性氢原子)。它的盐和酯被称为亚磷酸酯或膦酸酯。氧化态+4过磷酸,H4P2O6(或(HO)2P-P(OH)2)。四个氢都是酸性的。它的盐和酯是次磷酸盐。氧化态+5该组最重要的成员是磷酸,其中每个磷原子与四个氧原子结合,其中一个通过双键,排列成四面体的角。两个或多个这样的PO4四面体可以通过共享的单键氧原子连接,形成线性或支链、循环,或更复杂的结构。没有共享的单键氧原子是用酸性氢原子完成的。它们的通用公式是Hn-x+2PnO3n-x+1,其中n是磷原子的数量,x是分子结构中基本循环的数量。这些酸及其酯类和盐类(磷酸盐)包括一些最著名和最重要的磷的化合物。
化合物成员
编辑磷酸本身(也称为正磷酸或单磷酸),H3PO4(或OP(OH)3),一种三磷酸。它形成正磷酸盐和酯,通常称为磷酸盐。这类化合物中最小的具有两个或更多的磷原子的化合物称为低磷酸盐,较大的具有线性-P-O-骨架的化合物为多磷酸盐;两者之间没有明确的区别。一些最重要的成员是。焦磷酸,H4P2O7(或(HO)2P-O-P(OH)2),有四个酸氢。三磷酸(或三聚磷酸),H5P3O10(或(HO)2P-O-P(OH)-O-P(OH)2),有五个酸性氢。
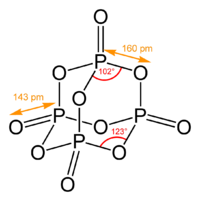
形成三磷酸盐或三聚磷酸盐。四磷酸盐,H6P4O13(或(HO)2P(-O-P(OH))2-O-P(OH)2),有六个酸性氢。形成四磷酸盐。主干可能是支链的,如:。三磷酸盐,H6P4O13或P(O)(-OP(O)(OH)2)3,是四聚磷酸的支链异构体。PO4四面体可以连接形成封闭的-P-O-链,如:。三聚磷酸(或环三聚磷酸),H3P3O9(或(HPO3)3,(-P(O)(OH)-O-)3),一个有三个酸性氢的环状分子。形成三磷酸盐和酯。偏磷酸是具有单一循环的磷酸的总称,(-P(O)(OH)-O-)n,其元素式为HPO3。焦磷酸H4P2O7三聚磷酸H5P3O10四聚磷酸H6P4O13三聚磷酸H3P3O9另一种可能包括在这一类的化合物是过氧单磷酸,H3PO5(或OP(OH)2(OOH)),可以看作是单磷酸,其中一个羟基中的氧原子被过氧化物取代混合氧化态一些磷氧化剂有两个或多个P原子处于不同的氧化态。一个例子是异磷酸盐,H4P2O6(或H(OH)(O)P-O-P(O)(OH)2),一种四元酸和次磷酸的异构体,含有氧化状态为+3和+5的P
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/156749/
