色散力
编辑色散力(LDF,也称为色散力、伦敦力、瞬时偶极诱导偶极力、波动诱导偶极键或松散地称为范德华力)是一种作用于通常电对称的原子和分子之间的分子间力 ; 也就是说,电子相对于原子核对称分布。
介绍
编辑原子或分子周围的电子分布随时间发生波动。 这些波动会产生瞬时电场,附近的其他原子和分子会感受到这些电场,进而调整它们自身电子的空间分布。 净效应是一个原子中电子位置的波动会引起其他原子中电子的相应重新分布,从而使电子运动变得相关。 虽然详细的理论需要量子力学的解释(见色散力的量子力学理论),但这种效应经常被描述为瞬时偶极子的形成(当被真空分开时)相互吸引。 色散力的大小经常用称为 Hamaker 常数的单个参数来描述,通常用符号 A {dISPlaystyle A} 表示。 对于距离比光的波长更近的原子,相互作用基本上是瞬时的,并用非延迟的 Hamaker 常数来描述。 对于相距较远的实体,第二个原子感受到一个原子的波动(延迟)所需的有限时间需要使用延迟的 Hamaker 常数。
虽然单个原子和分子之间的色散力非常弱,并且随着分离 R {diSPlaystyle R} 像 1 R 6 {displaystyle {frac {1}{R{6}}}} 一样迅速减小,在凝聚态 物质(液体和固体),效果在材料体积上或有机分子内部和有机分子之间累积,因此色散力在大块固体和液体中可能非常强,并且随着距离的增加衰减得更慢。 例如,两个大块固体之间每单位面积的总力减少 1 R 3 {displaystyle {frac {1}{R{3}}}} 其中 R {displaystyle R} 是它们之间的距离 . 色散力的影响在非常非极性的系统(例如,缺乏离子键)中最为明显,例如碳氢化合物和高度对称的分子,如溴(Br2,室温下为液体)或碘(I2,a 常温下为固体)。 在碳氢化合物和蜡中,分散力足以引起气相凝结成液相或固相。 升华热例如 碳氢化合物晶体反映了色散相互作用。 氧气和氮气液化成液相也受吸引色散力的支配。
当原子/分子被第三种介质(而不是真空)隔开时,情况变得更加复杂。 在水溶液中,由于与可极化溶剂分子的竞争,原子或分子之间的色散力的影响通常不太明显。 也就是说,溶剂(水)和其他分子都能感受到一个原子或分子的瞬时波动。
较大和较重的原子和分子比较小和较轻的原子和分子表现出更强的色散力。 这是由于具有更大、更分散的电子云的分子的极化率增加。 极化率是衡量电子重新分布的难易程度的指标; 大的极化率意味着电子更容易重新分布。 这种趋势以卤素为例(从小到大:F2、Cl2、Br2、I2)。 色散引力的增加在有机分子内部和之间发生,顺序为 RF、RCl、RBr、RI(从最小到最大)或与其他更易极化的杂原子。 氟和氯在常温下是气体,溴是液体,碘是固体。 伦敦力被认为是由电子的运动产生的。
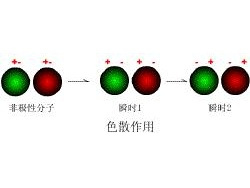
量子力学理论
编辑弗里茨·伦敦 (Fritz London) 于 1930 年首次解释了惰性气体原子之间的吸引力。他使用了基于二阶微扰理论的量子力学理论。 扰动是由于两个部分(原子或分子)的电子和原子核之间的库仑相互作用。 相互作用能的二阶微扰表达式包含状态总和。 此总和中出现的状态是单体受激电子状态的简单乘积。 因此,不包括电子态的分子间反对称化,并且仅部分满足泡利不相容原理。
London 对 1 R {displaystyle {frac {1}{R}}} 中的扰动进行了泰勒级数展开,其中 R {displaystyle R} 是原子核之间的距离。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214726/
