反应焓
编辑对于化学反应是总反应物和总产物摩尔焓之间的差异,针对处于标准状态的物质计算。 这反过来又可以用来预测反应过程中释放或结合的总化学键能,只要混合焓也被考虑在内。
已为大量物质确定的标准生成焓是指从其组成元素形成 1 摩尔物质时,所有物质都处于标准状态时的焓变。
可以在任何温度和压力下定义标准状态,因此必须始终指定标准温度和压力。 标准热化学数据的大多数值在(25°C,1 巴)或(25°C,1 atm)下制表。
对于水溶液中的离子,通常选择标准状态,使得浓度恰好为 1 摩尔/升的水溶液 H+ 的标准生成焓等于零,这使得阳离子和阴离子的标准焓列表成为可能 同标准浓度。 这种约定与电化学领域中标准氢电极的使用是一致的。 然而,在某些领域还有其他常见的选择,包括 H+ 的标准浓度恰好为 1 摩尔/(千克溶剂)(广泛用于化学工程)和 10 − 7 {dISPlaystyle 10{-7}} 摩尔/升 (用于生物化学领域)。 因此,在查阅生成焓表时,请务必注意使用的是哪个标准浓度值。
简介
编辑两个初始热力学系统,每个系统都处于各自独立的内部热力学平衡状态,可以通过热力学操作合并成一个新的最终孤立的热力学系统。 如果初始系统的化学组成不同,则最终系统的最终热力学平衡可能是化学反应的结果。 或者,在没有某种催化剂的情况下,孤立的热力学系统可以处于亚稳态平衡; 引入催化剂或其他一些热力学操作(例如释放火花)可以触发化学反应。 通常,化学反应会将一些化学势能转化为热能。 如果关节系统保持孤立,则其内能保持不变。 然而,这种热能表现为连接系统的非化学状态变量(如温度、压力、体积)的变化,以及描述化学反应的化学成分摩尔数的变化。
内能是相对于某些标准状态定义的。 在适当的热力学操作下,最终系统的化学成分可以达到它们各自的标准状态,同时能量以热量或热力学功的形式传递,这可以通过非化学状态变量的测量来测量或计算。 因此,标准反应焓的计算是量化化学势能转化为热能的最成熟的方法。
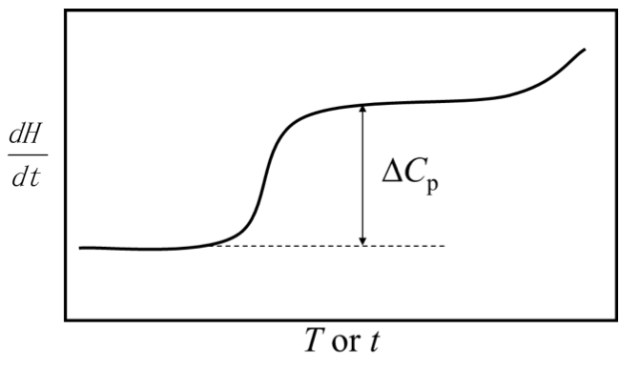
定义和测量的标准条件下的反应焓
编辑反应的标准焓被定义为仅取决于为其指定的标准条件,而不仅仅是取决于反应实际发生的条件。 实际进行热化学测量有两种一般条件。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/221274/
