硫循环
编辑硫循环是一种生物地球化学循环,其中硫在岩石、水道和生命系统之间移动。 它在地质学中很重要,因为它影响许多矿物质,在生活中也很重要,因为硫是一种必需元素 (CHNOPS),是许多蛋白质和辅助因子的组成部分,而硫化合物可用作微生物呼吸中的氧化剂或还原剂。 全球硫循环涉及硫物种通过不同氧化态的转化,这在地质和生物过程中都起着重要作用。硫循环的步骤是:
- 将有机硫矿化为无机形式,例如硫化氢 (H2S)、元素硫以及硫化物矿物。
- 将硫化氢、硫化物和元素硫 (S) 氧化成硫酸盐 (SO2−4)。
- 将硫酸盐还原为硫化物。
- 将硫化物并入有机化合物(包括含金属衍生物)。
这些通常被称为如下:
硫酸盐同化还原(另见硫同化),其中硫酸盐 (SO2−4) 被植物、真菌和各种 原核生物。 硫的氧化态在硫酸盐中为+6,在R-SH中为-2。脱硫,含硫有机分子脱硫,产生硫化氢气体(H2S,氧化态=-2)。 有机氮化合物的一个类似过程是脱氨。硫化氢的氧化产生元素硫 (S8),氧化态 = 0。该反应发生在光合作用的绿色和紫色硫细菌和一些化能无机生物中。 元素硫通常以多硫化物的形式储存。硫氧化剂对元素硫的氧化产生硫酸盐。异化硫还原,其中元素硫可还原为硫化氢。异化硫酸盐还原,其中硫酸盐还原剂从硫酸盐生成硫化氢。
硫氧化态
编辑硫在自然界中有四种主要的氧化态,分别是-2、+2、+4和+6。 各氧化态常见的硫物种如下:
S2−:H2S、(CH3)2S、BaS
S0:天然或元素硫
S2+:SCl2
S4+:SO2,亚硫酸盐 (SO2−3)
S6+: SO2−4 (H2SO4, CaSO4), SF6
硫源和汇
编辑硫的氧化态范围从 SO2 中的 +6 − 4 到硫化物中的 -2。 因此,元素硫可以根据其环境提供或接收电子。 在缺氧的早期地球上,大部分硫存在于黄铁矿 (FeS2) 等矿物中。 在地球历史上,由于火山活动以及含氧大气中地壳的风化作用,可移动硫的数量有所增加。 地球的主要硫汇是海洋 SO2−4,它是主要的氧化剂。</sub >
当 SO2−4 被生物同化时,它被还原并转化为有机硫,有机硫是蛋白质的重要组成部分 . 然而,生物圈并不是硫的主要汇集地,大部分硫存在于海水或沉积岩中,包括:富含黄铁矿的页岩、蒸发岩(硬石膏和重晶石)以及碳酸钙和碳酸镁(即与碳酸盐相关的 硫酸盐)。 海洋中硫酸盐的含量受三个主要过程控制:
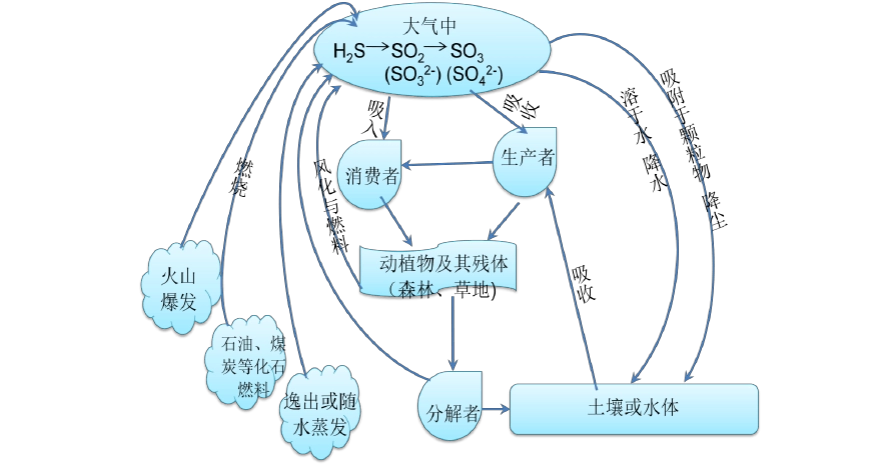
大气中硫的主要天然来源是海浪或风吹的富含硫的灰尘,这两种物质都不会长期存在于大气中。 近年来,每年燃烧煤和其他化石燃料产生的大量硫增加了大量的二氧化硫,成为空气污染物。 在过去的地质学中,火成岩侵入煤层导致这些煤层大规模燃烧,并随之向大气中释放硫。 这导致了气候系统的严重破坏,并且是二叠纪-三叠纪灭绝事件的拟议原因之一。
二甲基硫醚 [(CH3)2S 或 DMS] 是由海洋透光区中垂死的浮游植物细胞分解二甲磺酸丙酸酯 (DMSP) 产生的,是从海洋中排放的主要生物气体,它负责独特的 沿海岸线的“大海的味道”。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/229568/
