简介
编辑诱导性多能干细胞(也称为 iPS 细胞或 iPSC)是一种多能干细胞,可以直接从体细胞中产生。 iPSC技术由日本京都实验室率先提出,在2006年表明,引入四个特定基因(命名为Myc、Oct3/4、Sox2和Klf4),统称为Yamanaka因子,编码转录因子可以将体细胞转化为多能干细胞。
医学应用
编辑多能干细胞在再生医学领域大有可为。 因为它们可以无限繁殖,并产生体内所有其他细胞类型(如神经元、心脏、胰腺和肝细胞),它们代表了单一的细胞来源,可用于替代因损伤而丢失的细胞或疾病。
最著名的多能干细胞类型是胚胎干细胞。 然而,由于胚胎干细胞的产生涉及破坏(或至少操纵)植入前阶段的胚胎,因此围绕它们的使用存在很多争议。 现在可以使用体细胞核移植 (SCNT) 获得与患者匹配的胚胎干细胞系。
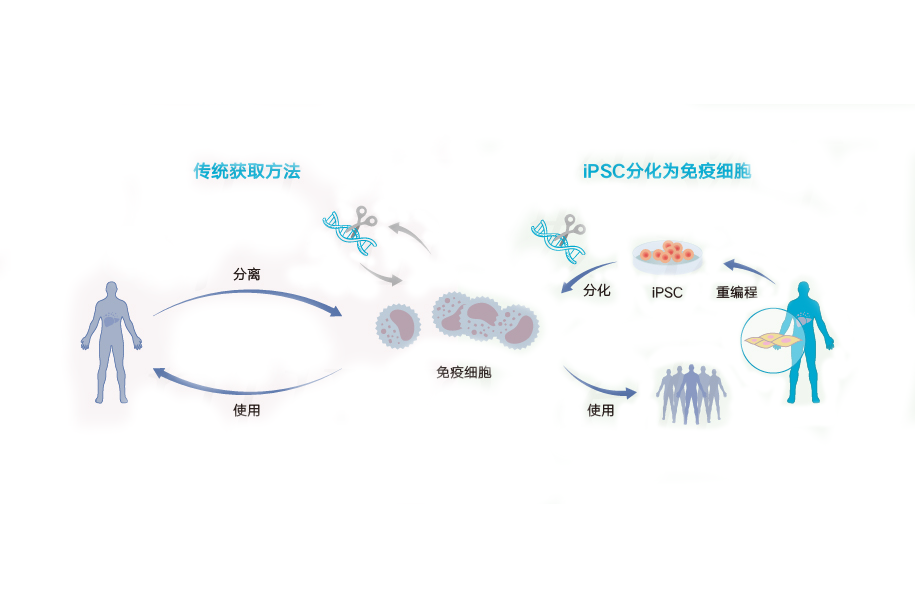
由于 iPSC 可以直接来源于成人组织,因此它们不仅不需要胚胎,而且可以以患者匹配的方式制造,这意味着每个人都可以拥有自己的多能干细胞系。 这些无限供应的自体细胞可用于产生没有免疫排斥风险的移植物。 虽然 iPSC 技术尚未发展到治疗性移植被认为是安全的阶段,但 iPSC 很容易用于个性化药物发现工作和了解特定患者的疾病基础。
制作
编辑iPSCs 通常是通过将特定多能性相关基因或重编程因子的产物引入给定细胞类型而衍生的。 最初的一组重编程因子(也称为 Yamanaka 因子)是转录因子 Oct4 (Pou5f1)、Sox2、Klf4 和 cMyc。 虽然这种组合是生产 iPSC 的最常规方法,但每个因子都可以在功能上被相关转录因子、miRNA、小分子,甚至是谱系特异性基因等非相关基因所取代。同样清楚的是,促有丝分裂因子,如 C-MYC/L-MYC 或抑制细胞周期检查点(例如 p53)是为 iPSC 重编程创建顺应性细胞状态的管道。
iPSC 衍生通常是一个缓慢且低效的过程,小鼠细胞需要 1-2 周,人类细胞需要 3-4 周,效率约为 0.01-0.1%。 然而,在提高效率和获得 iPSC 所需的时间方面已经取得了相当大的进步。 引入重编程因子后,细胞开始形成类似于多能干细胞的集落,可以根据其形态、选择其生长的条件或通过表面标记或报告基因的表达来分离这些细胞。
一代(鼠标)
编辑诱导性多能干细胞最早由日本京都大学的团队于 2006 年产生。他们假设对胚胎干细胞 (ESC) 功能重要的基因可能能够诱导成体细胞进入胚胎状态。 他们选择了 24 个先前被确定为在胚胎干细胞中重要的基因,并使用逆转录病毒将这些基因传递给小鼠成纤维细胞。 对成纤维细胞进行工程改造,以便可以使用抗生素选择来分离任何重新激活 ESC 特异性基因 Fbx15 的细胞。
在交付所有 24 个因子后,ESC 样菌落出现,重新激活 Fbx15 报告基因并可以无限繁殖。 为了确定重新编程所必需的基因,研究人员一次从 24 个基因库中删除一个因子。 通过这个过程,他们确定了四个因子,Oct4、Sox2、cMyc 和 Klf4,它们每个都是必要的,并且一起足以在选择下生成 ESC 样菌落以重新激活 Fbx15。
二代(鼠标)
编辑2007 年 6 月,三个独立的研究小组,发表了对重编程方法进行实质性改进的研究,从而产生了 iPSCs 与 ESC 没有区别。 与第一代 iPSC 不同,这些第二代 iPSC 产生了可存活的嵌合小鼠并促成了小鼠种系。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/250038/
