伽伐尼电池
编辑原电池、原电池或原电池链是一种将化学能自发转化为电能的装置。 两个不同电极和电解质的任意组合称为原电池,它们用作直流电压源。 特征值是外加电压。 原电池的容量是放电电流乘以时间的乘积。
一般
编辑伽玛尼电池系统地分为三组:
- 原电池,俗称电池。 其特点是组装后电芯充一次电,一次放电一次。 放电是不可逆的——原电池不能再充电。
- 二次电池,俗称蓄电池或简称充电电池。 放电后,二次电池可以通过与放电方向相反的电流再次充电,这就是为什么明确指定为负极和正极比指定为阳极和阴极更可取。 电池中的化学过程是可逆的,受循环次数的限制。 在相同温度下,二次电池的能量密度低于原电池。
- 燃料电池,也称为三级电池。 在这些原电池中,化学能量载体不储存在电池中,而是不断地从外部提供。 这种类型的饲料可实现连续且原则上不受限制的操作。
原电池的功能基于氧化还原反应。 还原和氧化分别在半电池(半元件)中进行。 通过用电子导体和离子导体连接两个半电池来闭合电路。 可以使用 Nernst 方程计算电气空载电压。 这取决于金属的类型(电化学系列)、相应半电池溶液中的浓度和温度。 与电解相反,例如在电镀中,可以在原电池中获得电能,而电解需要电能。
原电池放电时,负极始终为阳极(= 发生氧化的极),正极始终为阴极(= 发生还原的极)。 对此的助记符是“OMA(氧化、负极和阳极)”。 在二次电池的充电过程中,两极的化学反应是相反的:氧化发生在正极,这就是为什么它作为阳极发挥不同的作用 – 因此,负极然后是还原的地方,因此d即阴极。 因此,充电过程中反应的助记符为:“OPA(氧化、正极和阳极)”。
原电池提供电压,直到达到化学平衡。 没有电流流动但存在电极电压的原电池处于电化学平衡状态。
氧化发生在阳极,还原发生在阴极。
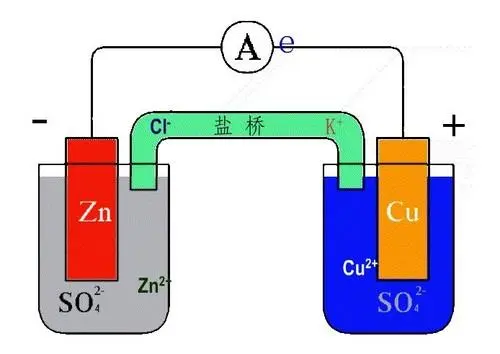
例子
编辑除了丹尼尔元件(铜/锌)之外,还可以使用铜和银电极创建原电池:铜电极浸入硫酸铜溶液中,银电极浸入硫酸银溶液中。 它们通过电线(电子导体)与电压表和离子导体连接。
如果两个电极通过电导体相互连接,则电极的不同氧化还原电势确保反应可以继续。 由于铜的氧化还原电势低于银,因此在铜电极处溶解的离子多于在银电极处溶解的离子。 因此,铜电极中的负电荷高于银电极中的负电荷,因此会产生将电子“推”向银电极的电压。 这导致银原子停止溶解;相反,多余的电子与硫酸银溶液中的银离子发生反应,导致它们像普通银原子一样附着在银电极上。
银离子在银电极处被还原为元素银:
2 A g + + 2 e − ⟶ 2 A g
因此,银电极是阴极(发生还原的电极)和原电池的正极(因为这里缺少电子)。
另一方面,铜电极发生以下氧化:
C u ⟶ C u 2 + + 2 e −
铜电极是原电池的阳极(发生氧化的电极)和负极(因为这里有多余的电子)。
因此在原电池中发生氧化还原反应,但反应部分在空间上彼此分开。 因此,电极室通过离子桥(盐桥)相互连接,这是闭合电路所必需的。 离子桥通常是充满电解质的 U 型管,其末端装有膜或隔膜(电化学)。 离子扩散通过盐桥发生,以抵消单个电池的充电。 另一种将电极空间彼此分开的方法是使用选择性渗透膜,这也能实现电荷均衡。 盐离子(在本例中为硝酸根离子)通过离子桥从阴极迁移到阳极,即从银半电池迁移到铜半电池。
丹尼尔电池是一种锌铜电池。 由于锌的惰性,锌半电池是主要发生锌原子氧化的半电池,因为惰性金属有失去电子的趋势。
Z n ⟶ Z n 2 + + 2 e −
该供体半电池(释放电子的半电池)中存在过量电子; 它形成负极。
电子现在通过导电连接从锌棒流向正极,即铜棒。 铜半电池是受体半电池,因为这是发生还原的地方。 铜棒中缺少电子。
C u 2 + + 2 e − ⟶ C u
如果只发生两个电极反应,则锌半电池中的溶液必须带正电,而铜半电池中的溶液将带负电,电子流就会停止。 然而,半电池中的总电荷不会改变,因为阳离子和阴离子的迁移导致溶液中的电荷均衡。
还有原电池具有两个相同的半电池,但它们的浓度不同,这些被称为浓度元件。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/334223/
