简介
编辑在热化学中,吸热过程(来自希腊语 ἔνδον (endon) ‘within’ 和 θερμ- (therm) ‘热,暖’)是任何热力学过程,其中焓 H(或内能 U)增加 系统的。 在这样的过程中,封闭系统通常从其周围吸收热能,这是向系统传递的热量。 因此,吸热反应通常会导致系统温度升高和环境温度降低。 它可能是一个化学过程,例如将硝酸铵(NH4NO3)溶解在水(H2O),或物理过程,例如冰块的融化。
这个词是由 19 世纪的法国化学家 Marcellin BERThelot 创造的。 与吸热过程相反的是放热过程,它释放或释放能量,通常以热的形式,有时以电能的形式。 因此,在每个术语(吸热和放热)中,前缀指的是过程发生时热量(或电能)的去向。
化学
编辑由于在各种过程(状态变化、化学反应)中键的断裂和形成,能量通常会发生变化。 如果形成键的能量大于断裂键的能量,则能量被释放。 这被称为放热反应。 但是,如果打破键所需的能量多于释放的能量,则能量会被吸收。 因此,这是一个吸热反应。
详情
编辑一个过程能否自发发生,不仅取决于焓变,还取决于熵变(ΔS)和绝对温度T。如果一个过程在一定温度下是自发过程,则生成物具有较低的吉布斯自由能G = H – TS 比反应物(放能过程),即使产物的焓更高。 因此,吸热过程通常需要系统中有利的熵增加 (ΔS > 0),以克服不利的焓增加,以便仍然 ΔG < 0。 0. 虽然吸热相转变为更无序的更高熵状态,例如 熔化和汽化是常见的,中等温度下的自发化学过程很少吸热。 在假设的强吸热过程中,焓增加 ΔH ≫ 0 通常导致 ΔG = ΔH – TΔS > 0,这意味着该过程不会发生(除非由电能或光子能驱动)。 吸热和放能过程的一个例子是
C 6 H 12 O 6 + 6 H 2 O ⟶ 12 H 2 + 6 CO 2 {dISPlaystyle {ce {C6H12O6 + 6 H2O -> 12 H2 + 6 CO2}}}Δ r H ∘ = + 627 kJ/mol , Δ r G ∘ = − 31 kJ/mol {diSPlaystyle Delta _{r}H{circ }=+627 {TeXt{kJ/mol}},quad Delta _{r}G{circ }=-31 {text{kJ/mol}}}
例子
编辑- 蒸发
- 升华
- 烷烃裂解
- 热分解
- 水解
- 恒星核中比镍重的元素的核合成
- 高能中子可以在吸热过程中从锂 7 产生氚,消耗 2.466 MeV。 这是在 1954 年 Castle Bravo 核试验产生出乎意料的高产量时发现的。
- 超新星中比铁重的元素的核聚变
- 将氢氧化钡和氯化铵溶解在一起
- 将柠檬酸和小苏打溶解在一起
吸热和吸热的区别
编辑术语吸热和吸热均源自希腊语 ἔνδον endon within 和 θέρμη thermē heat,但根据上下文,它们可能具有非常不同的含义。
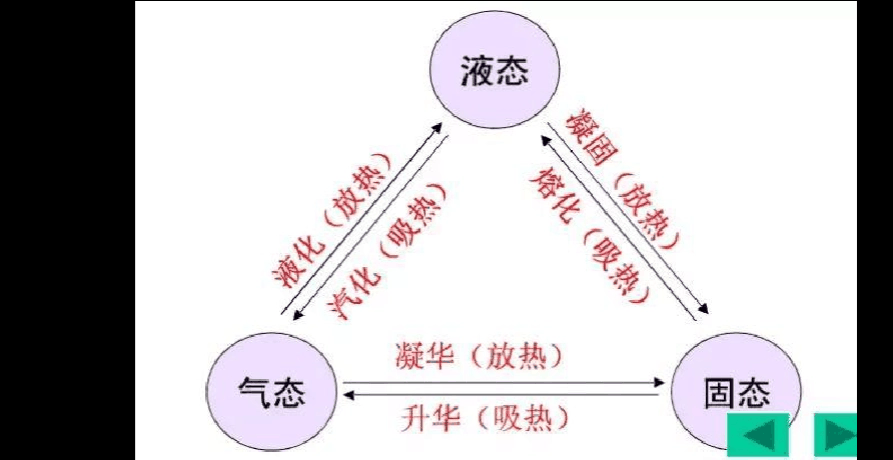
在物理学中,热力学适用于涉及系统及其周围环境的过程,吸热一词用于描述系统吸收能量的反应(相对于向外释放能量的放热反应)。
在生物学中,体温调节是生物体维持其体温的能力,术语吸热是指生物体可以通过利用其内部身体功能释放的热量从内部做到这一点(相对于外温,它依赖于外部 ,环境热源)以保持足够的温度。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/215905/
