米-门二氏动力学
编辑在生物化学中,米-门二氏动力学是最著名的酶动力学模型之一。 它以德国生物化学家 LEONor Michaelis 和加拿大医生 Maud Menten 的名字命名。 该模型采用描述酶促反应速率的方程式形式,通过关联反应速率 v {dISPlaystyle v}(产物形成速率,[ P ] {diSPlaystyle [{ce {P}}] } ) 到 [ S ] {displaystyle [{ce {S}}]} ,底物 S 的浓度。
这个方程称为 Michaelis-Menten 方程。 这里,V max {displaystyle V_{max }} 表示系统达到的最大速率,发生在给定酶浓度的饱和底物浓度下。 当米氏常数 K M {displaystyle K_{mathrm {M} }} 在数值上等于底物浓度时,反应速率是 V max {displaystyle V_{max }} 的一半 . 通常假设涉及单一底物的生化反应遵循米-门二氏动力学,而不考虑模型的基本假设。
型号
编辑1901 年,法国物理化学家 Victor Henri 发现酶反应是由酶和底物之间的键(更一般地,结合相互作用)引发的。 德国生物化学家 Leonor Michaelis 和加拿大医生 Maud Menten 接手了他的工作,他们研究了一种酶促反应机制的动力学,转化酶催化蔗糖水解成葡萄糖和果糖。 1913年,他们提出了反应的数学模型。 它涉及酶 E 与底物 S 结合形成复合物 ES,后者又释放产物 P,使原始酶再生。
其中 k f {displaystyle k_{f}}(正向速率常数),k r {displaystyle k_{r}}(反向速率常数),以及 k c a t {displaystyle k_{mathrm {cat} }}( 催化速率常数)表示速率常数,S(底物)和 ES(酶-底物复合物)之间的双箭头表示酶-底物结合是一个可逆过程,单向前箭头表示 P(产物 ).
在某些假设下——例如酶浓度远低于底物浓度
反应顺序取决于分母中两项的相对大小。
当所有酶都与底物结合时达到该速率。 k c a t {displaystyle k_{mathrm {cat} }} ,周转数,是每秒每个酶分子转化为产物的底物分子的最大数量。 进一步添加底物不会增加据说饱和的速率。
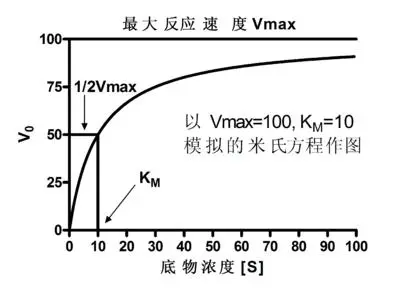
米氏常数 K M {displaystyle K_{mathrm {M} }} 的值在数值上等于反应速率为 [ S ] {displaystyle {ce {[S]}}} 在半最大值处,并且是底物对酶的亲和力的量度——小的 K M {displaystyle K_{mathrm {M} }} 表示高亲和力,这意味着速率将接近 V max { displaystyle V_{max }} 具有较低的 [ S ] {displaystyle {ce {[S]}}} 而不是具有较大 K M {displaystyle K_{mathrm {M} } } 。 该常数不受酶浓度或纯度的影响。 K M {displaystyle K_{mathrm {M} }} 的值取决于酶和底物的特性,以及温度和 pH 等条件。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/215991/
