歧化反应
编辑在化学中,歧化有时称为歧化,是一种氧化还原反应,其中一种中间氧化态的化合物转化为两种化合物,一种是较高氧化态,另一种是较低氧化态。 更一般地说,该术语可以应用于以下类型的任何去对称反应,无论它是氧化还原还是其他类型的过程:
2 A ⟶ A ′ + A ″ {dISPlaystyle {ce {2A -> A’ + A”}}}
例子
编辑Hg2Cl2 → Hg + HgCl2
4 H3PO3 → 3 H3PO4 + PH3
2 HCO-3 → CO2-3 + H2CO3在此酸碱反应中氧化数保持不变。 这个过程也称为自动电离。
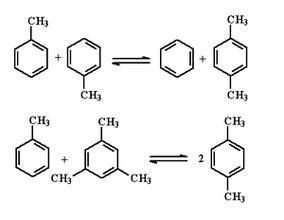
2 CH 3 − C ∙ H 2 ⟶ H 2 C = CH 2 + H 3 C − CH 3
逆反应
编辑歧化反应的逆过程,例如当处于中间氧化态的化合物由较低和较高氧化态的前体形成时,称为歧化反应,也称为歧化反应。
历史
编辑要详细研究的第一个歧化反应是:
2 Sn2+ → Sn4+ + Sn
更多示例
编辑- 氯气与稀氢氧化钠反应生成氯化钠、氯酸钠和水。 该反应的离子方程式如下: 3 Cl 2 + 6 OH – ⟶ 5 Cl – + ClO 3 – + 3 H 2 O
- 氯反应物处于氧化态 0。在产物中,Cl- 离子中氯的氧化数为 -1,已被还原,而 ClO3- 离子中氯的氧化数为 +5 , 说明它已经被氧化了。
- 许多卤间化合物的分解涉及歧化。 氟化溴经过歧化反应形成三氟化溴和溴: 3 BrF ⟶ BrF 3 + Br 2
- 超氧化物自由基歧化为过氧化氢和氧气,在生命系统中由超氧化物歧化酶催化: 2 O 2 − + 2 H + ⟶ H 2 O 2 + O 2 氧的氧化态在超氧自由基阴离子中为-1/2,在过氧化氢中为-1,在双氧中为0。
- 在坎尼扎罗反应中,醛转化为醇和羧酸。 在相关的 Tishchenko 反应中,有机氧化还原反应的产物是相应的酯。 在 Kornblum–DeLaMare 重排中,过氧化物转化为酮和醇。
- 在碘化钾或过氧化氢酶的催化下,过氧化氢歧化为水和氧气: 2 H 2 O 2 ⟶ 2 H 2 O + O 2
- 在 Boudouard 反应中,一氧化碳歧化为二氧化碳和二氧化碳。 该反应例如用于生产碳纳米管的 HiPco 方法,当在铁颗粒表面催化时,高压一氧化碳发生歧化: 2 CO ⟶ C + CO 2 {diSPlaystyle {ce {2 CO – > C + 二氧化碳}}}
- 氮在二氧化氮中的氧化态为 +4,但当该化合物与水反应时,会形成硝酸和亚硝酸,其中氮的氧化态分别为 +5 和 +3:2 NO 2 + H 2 O ⟶ HNO 3 + HNO 2
- 连二亚硫酸盐经酸水解生成硫代硫酸盐和亚硫酸氢盐: 2 S 2 O 4 2 − + H 2 O ⟶ S 2 O 3 2 − + 2 HSO 3
- 连二亚硫酸盐也会碱水解成亚硫酸盐和硫化物: 3 Na 2 S 2 O 4 + 6 NaOH ⟶ 5 Na 2 SO 3 + Na 2 S + 3 H 2 O3 NA2S2O4 + 6 氢氧化钠 -> 5 Na2SO3 + Na2S + 3 H2O}}}
- 通过用二氧化锰氧化冷却的二氧化硫水溶液大规模制备连二硫酸盐:2 MnO 2 + 3 SO 2 ⟶ MnS 2 O 6 + MnSO
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/228761/
