血蓝蛋白
编辑血蓝蛋白,是一种金属蛋白,血蓝蛋白含有两个铜原子,可以可逆地结合单个氧分子(O2)。它们作为氧运输分子的使用频率仅次于血红蛋白。不像在血红蛋白的红细胞中发现的脊椎动物,血蓝蛋白不结合至血细胞但不是直接在悬挂血淋巴。氧化导致颜色无色Cu(I)脱氧形式和蓝色Cu(II)氧化形式之间的变化。
物种分布
编辑血蓝蛋白仅在软体动物和节肢动物中发现:最早发现的血蓝蛋白是在蜗牛Helixpomatia(一种软体动物)和马蹄蟹(一种节肢动物)中。他们后来被发现是之间的共同头足类和甲壳类动物,并通过一些土地节肢动物被利用如狼蛛EurypelmacalifornICUm的帝王蝎和蜈蚣蚰蜒。此外,许多昆虫中的幼虫储存蛋白似乎来自血蓝蛋白。
血蓝蛋白超家族
编辑节肢动物血蓝蛋白超家族由酚氧化酶、六聚体蛋白、假血蓝蛋白或隐花青蛋白、(双翅目)六聚体蛋白受体组成。
酚氧化酶是含铜的酪氨酸酶。这些蛋白质参与节肢动物表皮的硬化过程、伤口愈合和体液免疫防御。酚氧化酶由酶原合成,并通过切割N端肽激活。
六聚蛋白是昆虫中常见的储存蛋白。这些蛋白质由幼虫脂肪体合成,与蜕皮周期或营养条件有关。
假血蓝蛋白和隐蓝蛋白基因序列与甲壳类动物的血蓝蛋白密切相关。这些蛋白质具有相似的结构和功能,但缺乏铜结合位点。
血蓝蛋白超家族系统发育中的进化变化与这些不同蛋白质在不同物种中的出现密切相关。如果没有对节肢动物血蓝蛋白的广泛研究,就不会很好地理解这个超家族中的蛋白质。
血蓝蛋白的结构和机制
编辑虽然血蓝蛋白的呼吸功能与血红蛋白相似,但其分子结构和机制存在显着差异。血红蛋白在卟啉环(血红素基团)中携带其铁原子,而血蓝蛋白的铜原子作为辅基结合,由组氨酸残基协调。血蓝蛋白的活性位点由一对铜(I)阳离子组成,通过六个组氨酸残基的咪唑环的驱动力直接与蛋白质配位。已经注意到,使用血蓝蛋白进行氧气运输的物种包括生活在低氧压力的寒冷环境中的甲壳类动物。在这些情况下,血红蛋白氧运输的效率低于血蓝蛋白氧运输。然而,也有使用血蓝蛋白的陆生节肢动物,特别是生活在温暖气候中的蜘蛛和蝎子。该分子在高达90摄氏度的温度下构象稳定并完全发挥作用。
大多数血蓝蛋白与氧气不合作地结合,并且在每单位血液量输送氧气方面的效率大约是血红蛋白的四分之一。由于蛋白质复合物中的空间构象变化,血红蛋白协同结合氧,当部分氧化时,这会增加血红蛋白对氧的亲和力。在马蹄蟹和其他一些节肢动物的一些血蓝蛋白中,观察到协同结合,希尔系数为1.6-3.0。希尔系数因物种和实验室测量设置而异。相比之下,血红蛋白的希尔系数通常为2.8-3.0。在这些合作绑定的情况下血蓝蛋白排列在6个亚基(六聚体)的蛋白质亚复合物中,每个亚基都有一个氧结合位点;氧在复合物中的一个单元上结合会增加相邻单元的亲和力。每个六聚体复合物排列在一起,形成一个更大的由数十个六聚体组成的复合物。在一项研究中,发现协同结合依赖于六聚体在更大的复合物中排列在一起,这表明六聚体之间存在协同结合。血蓝蛋白氧结合谱也受溶解盐离子水平和pH值的影响。
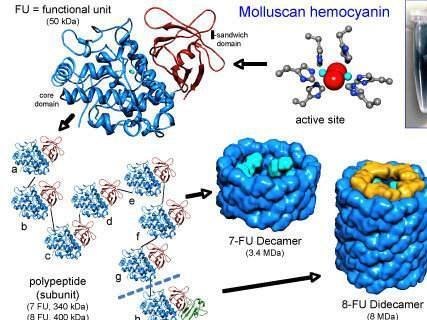
血蓝蛋白由许多单独的亚基蛋白组成,每个亚基蛋白含有两个铜原子,可以结合一个氧分子(O2)。每个亚基重约75千道尔顿(kDa)。根据物种的不同,亚基可以排列成二聚体或六聚体;二聚体或六聚体复合物同样以链或簇的形式排列,重量超过1500kDa。亚基通常是同质的,或具有两种变异亚基类型的异质亚基。由于血蓝蛋白的体积较大,与血红蛋白不同,它通常在血液中自由漂浮。
六聚体是节肢动物血蓝蛋白的特征。狼蛛Eurypelmacalifornicum的血蓝蛋白由4个六聚体或24个肽链组成。来自蜈蚣Scutigeracoleoptrata的血蓝蛋白由6个六聚体或36条链组成。马蹄蟹具有8-六聚体(即48-链)血蓝蛋白。在多刺龙虾Panulirusinterruptus和等足类动物bathynomusgiganteus中发现了简单的六聚体。甲壳类动物的肽链长约660个氨基酸残基,螯合物中的肽链长约660个氨基酸残基它们大约有625个。在大型复合物中,有各种长度相同的变异链;纯组件通常不会自组装。
催化活性
编辑血蓝蛋白与酚氧化酶(例如酪氨酸酶)同源,因为这两种蛋白质共享3型Cu活性位点配位。在这两种情况下,必须首先激活无活性的酶原,如血蓝蛋白、酪氨酸酶和CATCHoloxidase。这是通过在酶原不活跃时去除阻断活性位点入口通道的氨基酸来实现的。目前没有其他已知的修饰来激活酶原并实现催化活性。构象差异决定了血蓝蛋白能够执行的催化活性的类型。血蓝蛋白也表现出酚氧化酶活性,但由于活性位点的空间位阻增大而导致动力学减慢。部分变性实际上提高了血蓝蛋白的酚氧化酶活性,因为它提供了更多接近活性位点的途径。
光谱特性
编辑不存在O2时的血蓝蛋白活性位点(每个Cu中心是一个阳离子,电荷未显示)。O2结合形式的血蓝蛋白活性位点(Cu2中心是一个双阳离子,电荷未显示)。
氧合血蓝蛋白的光谱显示了几个显着特征:
- 共振拉曼光谱显示O2结合在对称环境中(ν(OO)不允许IR)。
- OxyHc是EPR沉默的,表明不存在未成对电子
- 红外光谱显示ν(OO)为755cm-1
许多工作致力于制备血蓝蛋白活性位点的合成类似物。一个这样的模型,其特征是一对铜中心通过过氧配体从侧面桥接,在741cm-1处显示ν(OO)以及在349和551nm处具有吸光度的UV-Vis光谱。这两个测量值都与oxyHc的实验观察结果一致。模型复合物中的Cu-Cu分离度为3.56Å,氧合血蓝蛋白的分离度约为3.56Å。3.6Å(脱氧Hc:约4.6Å)。
抗癌作用
编辑在智利鲍鱼Concholepasconcholepas血液中发现的血蓝蛋白对小鼠模型中的膀胱癌具有免疫治疗作用。小鼠在植入膀胱肿瘤(MBT-2)细胞之前用C.concholepas引发。用C.concholepas血蓝蛋白治疗的小鼠显示出抗肿瘤作用:延长生存期,降低肿瘤生长和发病率,并且没有毒性作用,并且可能在未来的浅表性膀胱癌免疫治疗中具有潜在用途。
Keyholelimpet血蓝蛋白(KLH)是一种免疫刺激剂,来源于海洋软体动物Megathuracrenulata的循环糖蛋白。KLH已被证明是一种有效的治疗方法,可在体外递送时对抗乳腺癌、胰腺癌和前列腺癌细胞的增殖。Keyholelimpet血蓝蛋白通过细胞死亡的凋亡和非凋亡机制抑制人类巴雷特食管癌的生长。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/124473/
