同素异形体
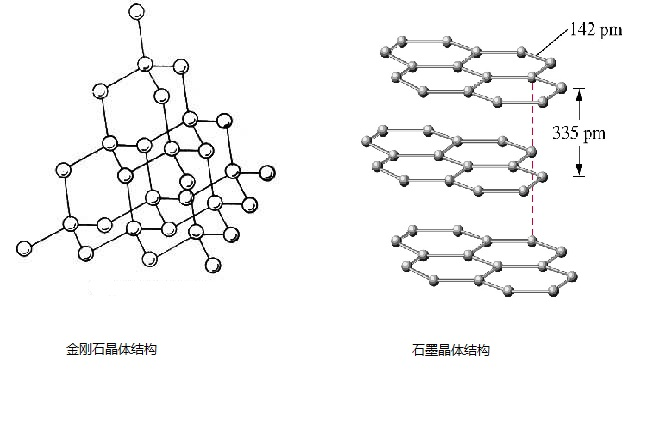
编辑同素异形体或同素异形体(来自古希腊语 ἄλλος (allos) ‘other’ 和 τρόπος (tropos) ‘manner, form’)是一些化学元素以两种或多种不同形式存在的特性,在 物理状态相同,称为元素的同素异形体。 同素异形体是一种元素的不同结构修饰:元素的原子以不同的方式键合在一起。例如,碳的同素异形体包括金刚石(碳原子键合在一起形成四面体的立方晶格)、石墨( 碳原子以六角晶格的形式键合在一起)、石墨烯(单片石墨)和富勒烯(碳原子以球形、管状或椭圆形的形式键合在一起)。
术语同素异形体仅用于元素,不适用于化合物。 用于任何化合物的更通用的术语是多晶型,尽管它的使用通常仅限于固体材料,例如晶体。 同素异形体仅指同一物理相(物质状态,如固体、液体或气体)内的元素的不同形式。 这些物质状态之间的差异并不能单独构成同素异形体的例子。 化学元素的同素异形体通常称为元素的多晶型物或相。
对于某些元素,同素异形体具有不同的分子式或不同的晶体结构,以及物理相的差异; 例如,氧气的两种同素异形体(分子氧 O2 和臭氧 O3)都可以固态、液态和气态存在。 其他元素在不同物理阶段不保持明显的同素异形体; 例如,磷有许多固体同素异形体,当熔化为液态时,它们都会恢复到相同的 P4 形式。
历史
编辑同素异形体的概念最初由瑞典科学家 Baron Jöns Jakob Berzelius(1779-1848)于 1840 年提出。 该术语源自希腊语 ìλλοτροπἱα (allotropia) ‘可变性,多变性’。 1860年阿伏加德罗假说被接受后,人们了解到元素可以多原子分子的形式存在,氧的两种同素异形体被认为是O2和O3。 在 20 世纪初,人们认识到碳等其他情况是由于晶体结构的差异造成的。
到1912年,奥斯特瓦尔德注意到元素的同素异形体只是化合物已知的多态现象的一个特例,并提出放弃同素异形体和同素异形体这两个术语,取而代之的是同素异形体和多态性。 尽管许多其他化学家重复了这一建议,但 IUPAC 和大多数化学教科书仍然赞成仅对元素使用同素异形体和同素异形体。
元素同素异形体的性质差异
编辑同素异形体是同一元素的不同结构形式,可以表现出截然不同的物理性质和化学行为。 同素异形体之间的变化是由影响其他结构的相同力触发的,即压力、光和温度。 因此,特定同素异形体的稳定性取决于特定条件。 例如,铁在 906°C 以上从体心立方结构(铁素体)转变为面心立方结构(奥氏体),而锡在 13.2°C 以下从金属形态转变为半导体形态,这被称为锡虫。 C(55.8°F)。 作为具有不同化学行为的同素异形体的一个例子,臭氧 (O3) 是比分子氧 (O2) 强得多的氧化剂。
同素异形体列表
编辑通常,具有可变配位数和/或氧化态的元素往往会表现出更多的同素异形体形式。 另一个影响因素是元素链接的能力。
同素异形体的例子包括:
非金属
编辑准金属
编辑金属
编辑在自然界中大量存在的金属元素中(56 到 U,不含 Tc 和 Pm),几乎一半 (27) 在环境压力下是同素异形体:Li、Be、Na、Ca、Ti、Mn、Fe、Co、 Sr、Y、Zr、Sn、La、Ce、Pr、Nd、Sm、Gd、Tb、Dy、Yb、Hf、Tl、Th、Pa 和 U。技术相关金属的同素异形体形式之间的一些相变是 Ti 的相变 在 882 °C,Fe 在 912 °C 和 1394 °C,Co 在 422 °C,Zr 在 863 °C,Sn 在 13 °C,U 在 668 °C 和 776 °C。
镧系元素和锕系元素
- 铈、钐、镝和镱具有三种同素异形体。
- 镨、钕、钆和铽有两种同素异形体。
- 钚在常压下有六种不同的固体同素异形体。 它们的密度在大约 4:3 的范围内变化,这使金属的各种工作(特别是铸造、机械加工和储存)变得非常复杂。 第七种钚同素异形体存在于非常高的压力下。 超铀金属Np、Am和Cm也是同素异形体。
- 钷、镅、锫和锎各有三种同素异形体。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/205243/
