叠氮酸
编辑叠氢酸,也称为叠氮化氢或偶氮亚胺,是一种化学式为HN3的化合物。 在常温常压下为无色易挥发易爆液体。 它是氮和氢的化合物,因此是一种磷氢化物。 它于 1890 年由 Theodor Curtius 首次分离出来。 这种酸的应用很少,但它的共轭碱基叠氮离子在特殊工艺中很有用。
加氢酸与其同类矿物酸一样,可溶于水。 未稀释的叠氮酸具有危险的爆炸性,标准生成焓 ΔfHo (l, 298K) = +264 kJ/mol。 稀释时,可安全配制气体和水溶液(<10%),但应立即使用; 由于其低沸点,叠氮酸在蒸发和冷凝时富集,使得不能爆炸的稀溶液可以在容器或反应器的顶部空间形成能够爆炸的液滴。
制作
编辑酸通常通过叠氮化钠等叠氮化物盐的酸化形成。 通常叠氮化钠的水溶液含有与叠氮化物盐平衡的微量叠氮酸,但引入更强的酸可以将溶液中的主要物质转化为叠氮酸。 随后可以通过分馏获得纯酸,其为极易爆炸的无色液体,具有难闻的气味。
NaN3 + HCl → HN3 + NaCl
其水溶液也可用稀硫酸处理叠氮化钡溶液,过滤不溶的硫酸钡制得。
最初由肼水溶液与亚硝酸反应制得:
N2H4 + HNO2 → HN3 + 2 H2O
与肼阳离子
处置前销毁
编辑加氢酸与亚硝酸反应:
HN3 + HNO2 → N2O + N2 + H2O
该反应的不同寻常之处在于它涉及具有四种不同氧化态的氮化合物。
反应
编辑叠氮酸的性质与氢卤酸有些相似,因为它形成难溶(在水中)的铅、银和汞(I)盐。 金属盐均以无水形式结晶并在加热时分解,留下纯金属的残留物。 它是一种弱酸 (pKa = 4.75)。它的重金属盐具有爆炸性,很容易与烷基碘相互作用。 较重的碱金属(不包括锂)或碱土金属的叠氮化物不会爆炸,但在加热时会以更可控的方式分解,释放出光谱纯的 N2 气体。 叠氮酸溶液溶解许多金属(如锌、铁)并释放氢并形成盐,称为叠氮化物(以前也称为叠氮化物或叠氮酸盐)。
加氢酸可与羰基衍生物反应,包括醛、酮和羧酸,生成胺或酰胺,同时排出氮。 这称为施密特反应或施密特重排。
在最强的酸中溶解会产生爆炸性的盐,其中含有
HN=N=N + H 此外,这些单分子速率已经在理论上进行了分析,实验速率和计算速率具有合理的一致性。
毒性
编辑加氢酸易挥发,有剧毒。 它有刺鼻的气味,其蒸气会引起剧烈的头痛。 该化合物是一种非累积毒物。
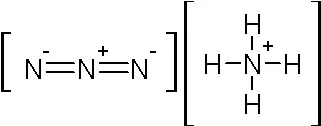
应用
编辑2-呋喃腈是一种药物中间体和潜在的人造甜味剂,通过用叠氮酸 (HN3) 和高氯酸 (HClO<sub) 的混合物处理糠醛,以高产率制备 class=”template-cheM2-sub”>4) 在 35 °C 的苯溶液中存在高氯酸镁。
全气相碘激光器(AGIL)将气态叠氮酸与氯气混合,产生激发态的氯化氮,再用其引起碘激光; 这避免了 COIL 激光器的液体化学要求。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/208706/
