简介
编辑等电点(pI、pH(I)、IEP)是分子不携带净电荷或在统计平均值中呈电中性时的 pH 值。 表示等电点的标准命名法是 pH(I)。 但是,也使用 pI。 为简洁起见,本文使用 pI。 分子上的净电荷受其周围环境的 pH 值影响,并且由于质子 (H+) 的增加或损失,可能会变得更带正电或带负电。
表面自然充电形成双层。 在通常情况下,当决定表面电荷的离子为 H+/HO- 时,净表面电荷会受到浸没固体的液体 pH 值的影响。
pI 值可以影响分子在给定 pH 值下的溶解度。 此类分子在与其 pI 相对应的 pH 值下在水或盐溶液中的溶解度最低,并且通常会从溶液中沉淀出来。 生物两性分子如蛋白质同时含有酸性和碱性官能团。 构成蛋白质的氨基酸本质上可能是正的、负的、中性的或极性的,它们共同赋予蛋白质整体电荷。 在低于其 pI 的 pH 值下,蛋白质带有净正电荷; 高于它们的 pI,它们带有净负电荷。 因此,可以使用制备凝胶电泳(使用恒定 pH 值分离蛋白质)或等电聚焦(使用 pH 梯度分离蛋白质)通过聚丙烯酰胺凝胶中的净电荷分离蛋白质。 等电聚焦也是二维凝胶聚丙烯酰胺凝胶电泳的第一步。
在生物分子中,蛋白质可以通过离子交换色谱法分离。 生物蛋白质由两性离子氨基酸化合物组成; 这些蛋白质的净电荷可以为正或负,具体取决于环境的 pH 值。 目标蛋白质的特定 pI 可用于模拟周围的过程,然后可以从混合物的其余部分中纯化化合物。 各种 pH 值的缓冲液可用于此纯化过程以改变环境的 pH 值。 当含有目标蛋白的混合物被加载到离子交换器中时,固定基质可以带正电(对于流动阴离子)或带负电(对于流动阳离子)。 在低 pH 值下,混合物中大多数蛋白质的净电荷为正 – 在阳离子交换剂中,这些带正电荷的蛋白质与带负电荷的基质结合。 在高 pH 值下,大多数蛋白质的净电荷为负,它们与阴离子交换剂中带正电的基质结合。 当环境的 pH 值等于蛋白质的 pI 时,净电荷为零,蛋白质不与任何交换剂结合,因此可以洗脱出来。
计算 pI 值
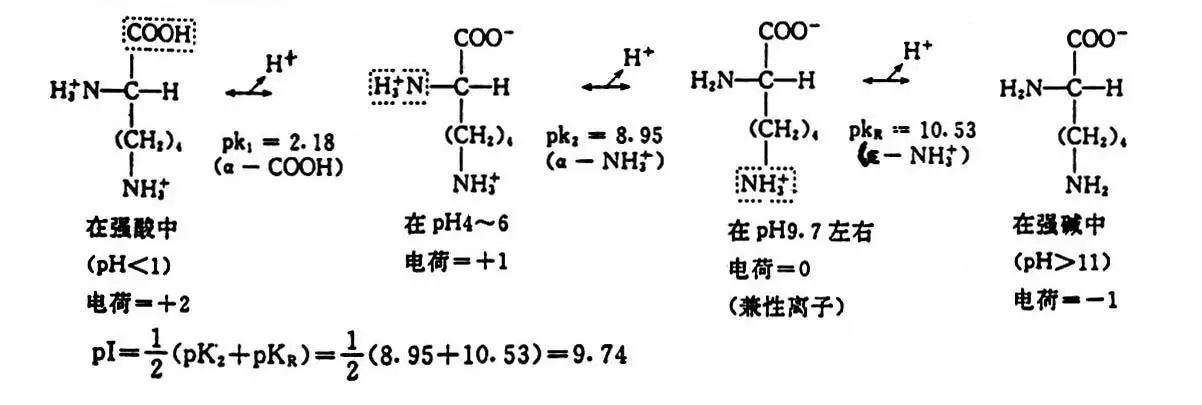
编辑对于只有一个胺基和一个羧基的氨基酸,可以从该分子的 pKas 的平均值计算 pI。
p I = p K a 1 + p K a 2 2 {dISPlaystyle mathrm {pI} ={frac {mathrm {p} K_{mathrm {a1} }+mathrm {p } K_{mathrm {a2} }}{2}}}
电泳凝胶的 pH 值由用于该凝胶的缓冲液决定。 如果缓冲液的 pH 高于正在运行的蛋白质的 pI,蛋白质将迁移到正极(负电荷被吸引到正极)。 如果缓冲液的 pH 值低于正在运行的蛋白质的 pI,蛋白质将迁移到凝胶的负极(正电荷被吸引到负极)。 如果蛋白质在缓冲液 pH 值等于 pI 的情况下运行,它根本不会迁移。 对于单个氨基酸也是如此。
例子
编辑在两个示例(右侧)中,等电点由绿色垂直线显示。 在甘氨酸中,pK 值相隔近 7 个单位。 因此在气相中,中性物质甘氨酸 (GlyH) 的浓度实际上是甘氨酸分析浓度的 100%。 甘氨酸在等电点可能以两性离子形式存在,但溶液中异构化反应的平衡常数。
H 2 NCH 2 CO 2 H ↽ − ⇀ H 3 N + CH 2 CO 2 − {diSPlaystyle {ce {H2NCH2CO2H <=>> H3N+CH2CO2-}}}
另一个例子,腺苷一磷酸被证明是为了说明原则上可能涉及第三种物质的事实。 事实上,在这种情况下,(AMP)H2+3 的浓度在等电点可以忽略不计。如果 pI 大于 pH,分子将带正电荷。
肽和蛋白质的等电点
编辑已经开发了许多用于估计肽和蛋白质等电点的算法。 他们中的大多数使用具有不同 pK 值的 Henderson–Hasselbalch 方程。 例如,在 Bjellqvist 及其同事提出的模型中,通过将同一样品聚焦在重叠的 pH 梯度中,可以确定密切相关的固定化物之间的 pK 值。 方法学的一些改进(尤其是修饰氨基酸的 pK 值的确定)。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/208884/
