配位键
编辑在配位化学中,配位共价键又称配位键、偶极键或配位键,是一种双中心双电子共价键,其中两个电子来自同一原子。 金属离子与配体的键合涉及这种相互作用。 这种类型的相互作用是路易斯酸碱理论的核心。
配位键通常存在于配位化合物中。
例子
编辑配位键无处不在。 在所有金属水络合物 [M(H2O)n]m+ 中,水与金属阳离子之间的键合被描述为配位共价键。 大多数有机金属化合物和大多数配位化合物中的金属-配体相互作用都有类似的描述。
术语偶极键在有机化学中用于化合物,例如氧化胺,其电子结构可以根据向氧原子提供两个电子的碱性胺来描述。
R3N → O
箭头 → 表示键中的两个电子都来自胺部分。 在标准共价键中,每个原子贡献一个电子。 因此,另一种描述是胺将一个电子提供给氧原子,然后与氮原子上剩余的未成对电子一起使用,形成标准的共价键。 电子从氮转移到氧的过程产生形式电荷,因此电子结构也可以描述为
R3N+O−
这种电子结构具有电偶极子,因此得名极性键。 实际上,原子带有部分电荷; 参与键合的两个原子中负电性较大的原子通常会带部分负电荷。 一个例外是一氧化碳。 在这种情况下,碳原子带有部分负电荷,尽管它的电负性不如氧。
配位共价键的一个例子是氨分子(在氮原子上带有孤对电子的路易斯碱)和三氟化硼之间的相互作用,三氟化硼是一种路易斯酸,因为硼原子具有不完整的八位位组 电子。 在形成加合物时,硼原子获得八位位组构型。
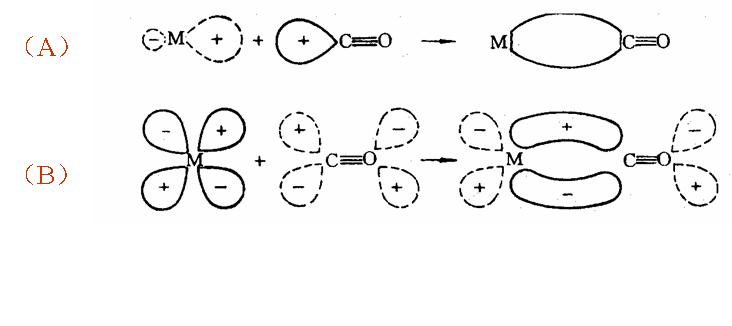
配位络合物的电子结构可以用一组配体来描述,每个配体向金属中心提供一对电子。 例如,在氯化六氨合钴 (III) 中,每个氨配体将其孤对电子提供给钴 (III) 离子。 在这种情况下,形成的键被描述为配位键。
与其他电子共享模式的比较
编辑在所有情况下,无论是配位键还是普通电子共享键,都是共价键。 在通常的用法中,前缀偶极、与格或坐标仅用于指示用于创建键的电子的来源。 例如,F3B ← O(C2H5)2(三氟化硼(二乙基)醚合物)由 BF3 和 :O(C2H5)2 制备,与自由基物种 [•BF3]– 和 [•O(C2H5)2] 相对 +。 与格键在符号方面也很方便,因为避免了正式的费用:我们可以写 D: + ()A ⇌ D → A 而不是 D+–A–(这里 : 和 () 代表孤对和空 分别在电子对供体 D 和受体 A 上运行)。 即使所涉及的路易斯酸碱反应只是名义上的,有时也会使用该符号(例如,亚砜 R2S → O 很少通过硫化物 R2S 与原子氧 O 反应生成)。 因此,大多数化学家在选择一种表示法而不是另一种表示法(正式电荷与箭头键)时,不会对键的属性做出任何声明。
然而,通常情况下,以这种方式描述的键是极性共价键,有时是极共价键,一些作者声称配键和共享电子键的性质存在真正差异,并建议显示配键更重要 适合特定情况。
早在 1989 年,HaalAND 就将与格债券描述为 (i) 弱而长的债券; (ii) 在债券形成过程中仅发生少量电荷转移; (iii) 其在气相(或低 ε 惰性溶剂)中的首选解离模式是异裂而非均裂。 氨-硼烷加合物 (H3N → BH3) 是一个典型的例子:键很弱,解离能为 31 kcal/mol(乙烷为 90 kcal/mol),键长,在 166 pm(cf . 153 pm 对于乙烷),并且该分子具有 5.2 D 的偶极矩,这意味着只有 0.2 e- 从氮转移到硼。 H3N → BH3 的异裂离解估计需要 27 kcal/mol,证实异裂解成氨和硼烷比均裂解成自由基阳离子和自由基阴离子更有利。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214663/
