孤电子对
编辑在化学中,孤电子对是指在共价键中不与另一个原子共享的一对价电子,有时称为非共享对或非键合对。 孤电子对存在于原子的最外层电子壳中。 它们可以通过使用路易斯结构来识别。 因此,如果两个电子配对但不用于化学键合,则电子对被认为是孤对。 因此,孤对电子数加上成键电子数等于原子周围的价电子数。
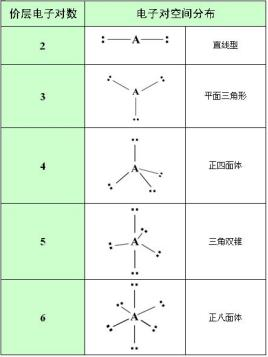
孤电子对是解释分子形状的价层电子对排斥理论(VSEPR理论)中使用的概念。 它们在路易斯酸和碱的化学中也有提及。 然而,并非所有非键合电子对都被化学家认为是孤电子对。 例子是过渡金属,其中非键合对不影响分子几何形状,据说在立体化学上是不活泼的。 在分子轨道理论(完全离域的规范轨道或以某种形式局域化)中,孤对的概念不太明确,因为轨道和路易斯结构的组成部分之间的对应关系通常并不简单。 然而,占据的非键合轨道(或大部分非键合特征的轨道)经常被识别为孤对。
单个孤对原子可以在氮基团中找到,例如氨中的氮。 两个孤对可以在硫属元素组中的原子中找到,例如水中的氧。 卤素可以携带三个孤对电子,例如氯化氢。
在 VSEPR 理论中,水中氧原子上的电子对形成四面体的顶点,四个顶点中的两个顶点上有孤电子对。 H–O–H 键角为 104.5°,小于四面体角预测的 109°,这可以用孤对之间的排斥相互作用来解释。
已经提出了存在孤对电子的各种计算标准。 虽然电子密度 ρ(r) 本身在这方面通常不提供有用的指导,但电子密度的拉普拉斯算子很有启发性,孤对位置的一个标准是其中 L(r) = –∇2ρ(r) 是局部最大值。 静电势 V(r) 的最小值是另一个建议的标准。 还有一个考虑电子定位功能(ELF)。
角度变化
编辑这些对通常表现出负极性,具有高电荷密度,并且与键合电子对相比,它们平均更靠近原子核。 孤对电子的存在降低了键合电子对之间的键角,因为它们的高电荷导致电子之间的巨大排斥。 它们还参与了配位键的形成。 例如,当酸溶解在水中时会产生水合氢 (H3O+) 离子,这是由于氧原子向氢离子提供孤对电子。
当在两个更常见的分子中观察时,可以更清楚地看到这一点。 例如,在二氧化碳 (CO2) 中,氧原子位于碳的相对两侧(线性分子几何),而在水 (H2O) 中,氢原子之间的角度为 104.5°(弯曲分子几何)。 氧原子孤对电子的排斥力将氢原子推得更远,直到氢原子上所有电子的力达到平衡。 这是 VSEPR 理论的一个例子。
偶极矩
编辑孤电子对可以影响分子的偶极矩。 NH3 的偶极矩为 1.42 D。由于氮的电负性 (3.04) 大于氢的电负性 (2.2),结果是 N-H 键是极性的,氮原子上带有净负电荷和较小的净正电荷 氢原子上。 还有一个与孤对偶相关的偶极子,这加强了极性共价 N-H 键对氨偶极矩的贡献。 与 NH3 相比,NF3 的偶极矩低得多,为 0.234 D。氟比氮更具电负性,并且 N-F 键的极性与氨中 N-H 键的极性相反,因此由于孤对产生的偶极子相反 N-F键偶极子,导致低分子偶极矩。
立体孤对
编辑当连接到一个原子上的其他三个基团都不同时,孤对可以促成分子中手性的存在。 在某些胺、膦、硫离子和氧离子、亚砜甚至碳负离子中都可以看到这种效果。
立体异构中心为胺的对映异构体的拆分通常被排除在外,因为立体中心氮转化的能垒较低,这使得两种立体异构体在室温下可以快速相互转化。 因此,此类手性胺无法解析,除非胺基团被限制在环状结构中(例如在 Tröger 碱中)。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214724/
