简介
编辑在热力学中,放热过程是一种热力学过程或反应,它从系统向周围环境释放能量,通常形式为 热,但也以光(例如火花、火焰或闪光)、电(例如电池)或声音(例如燃烧氢气时听到的爆炸声)的形式。 放热一词最早是由 19 世纪的法国化学家 Marcellin BERThelot 创造的。
与放热过程相反的是吸热过程,吸热过程通常以热量的形式吸收能量。 这个概念在物理科学中经常应用于化学反应,在化学反应中,化学键能转化为热能(热)。
两种化学反应
编辑放热和吸热描述了自然界中发现的两种类型的化学反应或系统,如下所示:
放热
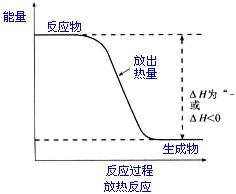
编辑放热反应后,释放到周围环境的能量多于为启动和维持反应而吸收的能量。 一个例子是蜡烛的燃烧,其中燃烧产生的卡路里总和(通过观察周围环境的辐射加热和产生的可见光发现,包括燃料(蜡)本身的温度升高,转化为 热的 CO2 和水蒸气)超过了最初在点燃火焰和火焰自身维持过程中吸收的卡路里数量(一些能量被重新吸收并用于熔化,然后汽化蜡等,但远远超过在燃烧时释放的能量 产生 CO2 和 H2O)。
吸热
编辑在吸热反应或系统中,能量是在反应过程中从周围环境中获取的,通常是由系统中有利的熵增加驱动的。 吸热反应的一个例子是急救冷敷袋,其中两种化学物质的反应,或一种化学物质溶解在另一种化学物质中,需要来自周围环境的热量,并且该反应通过吸收它们的热量来冷却小袋和周围环境。
光合作用是植物将二氧化碳和水转化为糖和氧气的过程,是一个吸热过程:植物从太阳吸收辐射能并将其用于吸热过程,否则是非自发过程。 储存的化学能可以通过逆(自发)过程释放:糖的燃烧,产生二氧化碳、水和热量(辐射能)。
能量释放
编辑放热是指封闭系统向周围环境释放能量(热量)的转变,表示为
Q< 0. {dISPlaystyle Q<0.}
当在恒定压力下发生转变且没有电能交换时,热量 Q 等于焓变,即
ΔH< 0 , {diSPlaystyle Delta H<0,}
而在恒定体积下,根据热力学第一定律,它等于内能 (U) 的变化,即
ΔU = Q + 0 < 0. {displaystyle Delta U=Q+0<0.}
在绝热系统(即不与周围环境进行热交换的系统)中,否则放热过程会导致系统温度升高。
在放热化学反应中,反应释放的热量以电磁能或分子动能的形式存在。 电子从一个量子能级跃迁到另一个量子能级导致光被释放。 这种光的能量相当于化学反应能量的一些稳定能量,即键能。 释放的这种光可以被溶液中的其他分子吸收,从而引起分子平移和旋转,从而产生对热的经典理解。 在放热反应中,活化能(开始反应所需的能量)小于随后释放的能量,因此存在净能量释放。
例子
编辑放热过程的一些例子是:
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/215954/
