膜蛋白
编辑膜蛋白,总蛋白质的一半以上与膜有关。膜蛋白根据其与膜之间关系的强度分为两种类型。
固有膜蛋白
编辑固有膜蛋白是始终附着在膜上的蛋白,需要表面活性剂或非极性溶剂(如十二烷基硫酸钠)才能分离。
- 单跨膜蛋白是仅在一端结合膜的蛋白。
表面膜蛋白
编辑表面膜蛋白是一种通过共价键以外的力(如疏水相互作用或静电相互作用)暂时与脂质双层膜或整体膜蛋白结合的蛋白。为了分离它们,需要高盐浓度的极性溶剂。
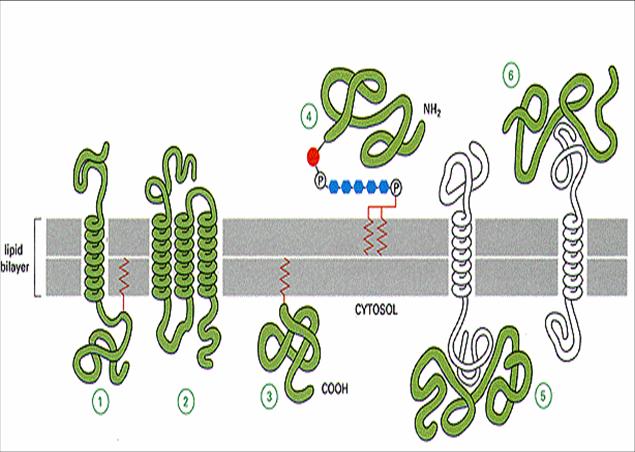
其他其他内源性肤浅,翻译后修饰中的脂肪酸,苯基链,糖基等添加,它们被锚定到脂质双层作为锚。
内源性和表面分类不适用于多肽毒素,例如大肠菌素 A和α- 溶血素或某些涉及凋亡的蛋白质。这些蛋白质是水溶性的,但不可逆地与脂质双层结合形成具有α-螺旋或β-桶状结构的跨膜通道。在另一种分类方法,我们把所有的膜蛋白的内源性和两亲性。两亲性蛋白质具有两种特性:它们溶解于水中并与脂质结合,而内源性蛋白质仅吸收膜。两亲性蛋白质还包括水溶性且形成通道的多肽毒素。
膜结合蛋白
与膜相互作用的蛋白质也很多,例如非核糖体肽。它们短杆菌肽形成的跨膜通道作为,离子载体如离子或使其通过膜,或与脂质双层表面相互作用。这些蛋白质是分泌的蛋白质,其中一些溶解度低,但被分类为两亲性的。
膜蛋白注意事项
编辑对于可溶性蛋白,可以相对容易地确定三维结构,但是对于膜蛋白,则很难确定。X射线晶体学的最大问题是膜蛋白的结晶。为了使膜蛋白结晶,需要使用适当的表面活性剂使膜溶解,但是,设定这些条件和在表面活性剂的存在下结晶非常困难,需要耐心。使用常规的蒸汽扩散法通过结晶很难获得高质量的膜蛋白晶体。脂质立方相法(LCP法),HiLiDe法,BicELLE法等作为使膜蛋白结晶的有效方法受到关注。特别地,脂质立方相法是一种结晶法,已被报道比气相扩散法更频繁。脂质立方相已在1996年提出了通过朗道和Rosenbusch。科比尔卡.beta.2肾上腺素能受体对这些凹槽和的G蛋白例如复合物已通过脂质立方相方法结晶结构分析是脂质立方相的巨大成就之一。与通常用于蛋白质结晶的气相扩散法不同,脂质立方相法是一种在称为立方相的三维连续脂质层中使膜蛋白重结晶并进行结晶的技术。由于表面活性剂覆盖的膜蛋白区域被脂质替代,因此很可能被密集地聚集并且倾向于获得高分辨率的晶体。另外,RIKEN等人的横山重行(Shigeyuki Yokoyama)使用了基于源自大肠杆菌的CECF方法的无细胞蛋白质合成系统。它是在2009年开发了使用合成的膜蛋白的方法。后来,开发了一种可溶性膜破碎方法(S-MF方法),该方法可以生产高浓度的样品而无需用表面活性剂溶解。不仅结晶而且膜蛋白的低表达水平也使分析变得困难。
除了X射线晶体结构分析方法之外,还有计算机模拟方法,例如分子动力学方法和亲水性分析法,用于预测拓扑,作为获得结构信息的方法。这些方法无需执行结构分析即可提供结构信息。此外,如果成功地稳定地溶解和纯化了膜蛋白,即使不能获得高质量的晶体,也可以通过X射线以外的方法获得一些结构信息。电子显微镜,NMR方法,电子自旋共振方法等已知为能够确定三维结构的方法。电子显微镜有两种主要的结构分析方法。一种是使用二维晶体的方法,也称为电子束晶体方法。尽管可以以高分辨率确定三维结构,但是必须创建二维晶体(单层结构)。另一种是单颗粒分析,这是一种通过分别收集大量蛋白质分子图像并取统计平均值来提高分析准确性的方法。在任何电子显微镜中,由于电子束引起的蛋白质的物理损伤在任何方法中都是一个严重的问题,并且测量是在非常低的样品温度下进行的。根据样品状态的不同,NMR法分为溶液NMR法和固体NMR法。溶液NMR法必须完全用表面活性剂等溶解,但是可以高分辨率确定三维结构并分析与配体等的分子间相互作用。溶液NMR方法与其他方法有很大不同,因为它需要完全溶解的状态才能进行结构分析,但就溶解条件而言,它是最佳方法。固态NMR方法可进行各种样品状态的分析,并可显着提高低温条件下的灵敏度。在电子自旋共振方法中,自由基之间的距离是通过将多个称为自旋标记的低反应性自由基引入到膜蛋白中而获得的。通过收集大量的径向间距,可以以低分辨率确定三维结构。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/103761/
