什么是胞质分裂
编辑胞质分裂是部分细胞分裂 过程,在此期间细胞质单一的真核细胞分裂成两个子细胞。期间或中晚期后细胞质分裂开始核分裂在有丝分裂和减数分裂。在胞质分裂过程中,纺锤体设备将复制的染色单体分配并运输到分离子体的细胞质中细胞。从而确保从一代到下一代保持染色体数目和补体,并确保在特殊情况下,子细胞将是亲本细胞的功能性拷贝。在完成后末期和胞质分裂,每个子细胞进入相间的的细胞周期。
(adsbyGOOGLE = window.adsbygoogle || []).push({});
特定功能要求与对称胞质分裂过程不同的偏离;例如在动物的卵发生中,卵子几乎吸收了所有的细胞质和细胞器。剩下的极体几乎没有功能而死亡,尽管极体在其他物种中承担着各种特殊的功能。有丝分裂的另一种形式发生在肝脏和骨骼肌等组织中;它省略了胞质分裂,从而产生了多核细胞。
植物细胞分裂与动物细胞分裂不同,部分原因是植物细胞壁的刚性。代替植物细胞形成诸如在动物子细胞之间发展的分裂沟,被称为细胞板的分裂结构在细胞质中形成,并在植物子细胞之间生长成新的,双倍的细胞壁。它将单元划分为两个子单元。
细胞分裂在很大程度上类似于二元裂变的原核过程,但由于原核和真核细胞结构和功能之间的差异,其机制有所不同。例如,与真核生物的线性的,通常是多个的染色体相比,细菌细胞只有一个呈闭环形式的染色体。因此,细菌在细胞分裂中不构建有丝分裂纺锤体。同样,原核DNA的复制发生在实际分离染色体的过程中。在有丝分裂中,尽管子代染色单体并没有在分裂后期完全分离,但在有丝分裂开始之前的中间阶段发生了复制。
动物细胞
编辑动物细胞胞质分裂开始的妹妹发病后不久,染色单体的分离后期的有丝分裂。该过程可分为以下不同步骤:后期纺锤体重组,分割平面规格,肌动蛋白–肌球蛋白环组装和收缩以及脱落。通过分子信号传导途径对上述单个事件的紧密时间协调,确保了基因组向新兴子细胞的忠实分配。
后期主轴重组
编辑动物细胞胞质分裂始于微管的稳定和有丝分裂纺锤体的重组以形成中心纺锤体。所述中心轴(或主轴midzone)当非着丝粒的微管的纤维的纺锤极之间捆绑形式。许多有效的物种,包括H. sapiens、D.melanogaster和C. elegans,都需要中心纺锤体才能有效地进行胞质分裂,尽管与其缺失相关的特定表型在一个物种到另一个物种之间有所不同(例如,某些果蝇细胞)两种类型的线虫都不能在没有中心纺锤的情况下形成卵裂沟 在胚胎和人类组织培养细胞中,观察到分裂沟的形成和进入,但在胞质分裂完成之前就退缩了。有丝分裂纺锤体重组和中心纺锤体形成的过程是由后期CDK1活性下降引起的。CDK1活性在中期-后期过渡期的下降导致多个中心纺锤体组件上抑制位点的去磷酸化。首先,从CPC的一个亚基(染色体乘客复合体)中去除CDK1磷酸化使其可以从着丝粒转移到中央轴心,在中间期它位于该中心。CPC除了是中央纺锤体本身的结构组件外,在其他中央纺锤体组件的磷酸化过程中也发挥着作用,包括PRC1(胞质分裂1所需的微管束蛋白)和MKLP1(驱动蛋白运动蛋白)。原本受CDK1介导的磷酸化抑制,PRC1现在能够形成同二聚体,该同二聚体选择性结合至反平行微管之间的界面,促进中心纺锤体的微管的空间组织。MKLP1与Rho家族GTPase激活蛋白CYK-4(也称为MgcRacGAP)一起形成了中央SPindlin复合物。Centralspindlin作为高阶簇绑定到中心纺锤。Centralspindlin簇的形成是由CPC的Aurora B磷酸化MLKP1促进的。简而言之,在中期-后期过渡期,直接或间接降低CDK1活性可通过多个中央主轴组件的磷酸化来启动中央主轴的自组装。中心纺锤体在胞质分裂中可能具有多种功能,包括控制卵裂沟的定位,将膜囊泡输送至卵沟。
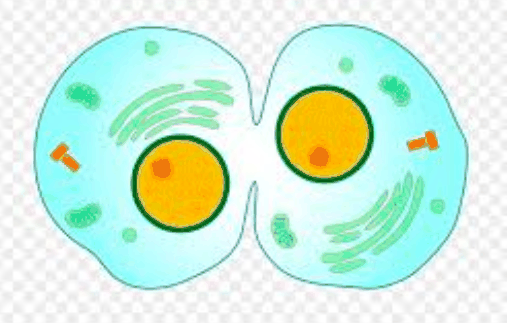
分割平面规格
编辑动物细胞胞质分裂的第二步涉及分裂平面规格和细胞动力学沟形成。精确定位两个分离的染色体块之间的划分平面对于防止染色体丢失至关重要。同时,纺锤体决定动物细胞分裂平面的机制可能是胞质分裂最持久的谜,并且引起了激烈的争论。存在沟纹诱导的三个假设。第一个是星体刺激假说,它假设来自纺锤体极的星体微管将皱纹诱导信号传递到细胞皮层,其中来自两个极的信号以某种方式聚焦到纺锤体的环中。第二种可能性,称为中心纺锤假说,是沟裂由起源于中心纺锤赤道的正刺激引起。中心纺锤体可以通过促进小GTPase RhoA在赤道皮层的集中和激活来有助于划分平面的规范化。第三个假设是星体弛豫假设。它假定活性肌动蛋白-肌球蛋白束分布在整个细胞皮质中,并且抑制它们在纺锤极附近的收缩会导致收缩活动的梯度在两个极之间的中点处最高。换句话说,星状微管会产生一个负信号,增加靠近极点的皮质松弛。秀丽隐杆线虫胚胎的遗传和激光显微操作研究表明,纺锤体向细胞皮层发送了两个冗余信号,一个来自中央纺锤体,另一个来自纺锤体翠菊,这暗示了多种机制的参与。乳沟的位置。一个特定信号的优势在细胞类型和生物之间变化。并且可能需要信号的大量和部分冗余,以使系统健壮并提高空间精度。星状微管产生负信号,增加靠近极点的皮质松弛。秀丽隐杆线虫胚胎的遗传和激光显微操作研究表明,纺锤体向细胞皮层发送了两个冗余信号,一个来自中央纺锤体,另一个来自纺锤体翠菊,这暗示了多种机制的参与。乳沟的位置。一个特定信号的优势在细胞类型和生物之间变化。并且可能需要信号的大量和部分冗余,以使系统健壮并提高空间精度。星状微管产生负信号,增加靠近极点的皮质松弛。秀丽隐杆线虫胚胎的遗传和激光显微操作研究表明,纺锤体向细胞皮层发送了两个冗余信号,一个来自中央纺锤体,另一个来自纺锤体翠菊,这暗示了多种机制的参与。乳沟的位置。一个特定信号的优势在细胞类型和生物之间变化。并且可能需要信号的大量和部分冗余,以使系统健壮并提高空间精度。线虫胚胎已经表明纺锤体向细胞皮层发送了两个冗余信号,一个信号源自中心纺锤体,另一个信号源自纺锤体翠菊,这暗示着多种机制参与了卵裂沟的定位。一个特定信号的优势在细胞类型和生物之间变化。并且可能需要信号的大量和部分冗余,以使系统健壮并提高空间精度。线虫胚胎已经表明纺锤体向细胞皮层发送了两个冗余信号,一个信号源自中心纺锤体,另一个信号源自纺锤体翠菊,这暗示着多种机制参与了卵裂沟的定位。一个特定信号的优势在细胞类型和生物之间变化。并且可能需要信号的大量和部分冗余,以使系统健壮并提高空间精度。
肌动蛋白-肌球蛋白环的组装和收缩
编辑在胞质分裂沟处,是肌动蛋白-肌球蛋白收缩环驱动切割过程,在此过程中,细胞膜和壁向内生长,最终将母细胞一分为二。该环的关键成分是丝状蛋白肌动蛋白和运动蛋白肌球蛋白II。收缩环在细胞皮层(与细胞膜相邻)处赤道组装(在细胞中间)。Rho蛋白家族(哺乳动物细胞中的RhoA蛋白)是动物细胞中收缩环形成和收缩的关键调节剂。RhoA途径通过两个主要效应子促进肌动蛋白-肌球蛋白环的组装。首先,RhoA通过激活透照相关的formins刺激非支链肌动蛋白丝的成核。新肌动蛋白丝的这种局部生成对于收缩环的形成很重要。[6]肌动蛋白丝的形成过程还需要一种称为蛋白纤维蛋白的蛋白,该蛋白与肌动蛋白单体结合并帮助将其加载到丝端。其次,RhoA通过激酶ROCK促进肌球蛋白II的激活,而ROCK激酶通过肌球蛋白轻链的磷酸化直接激活肌球蛋白II,并且还通过靶向磷酸酶的亚基MYPT的磷酸化抑制肌球蛋白磷酸酶。除了肌动蛋白和肌球蛋白II,收缩环还包含支架蛋白anillin。Anillin与肌动蛋白,肌球蛋白,RhoA和CYK-4结合,从而将赤道皮质与来自中心纺锤体的信号联系起来。它还有助于肌动蛋白-肌球蛋白环与质膜的连接。还已经推测另一种蛋白,Septin,可以用作组织胞质分裂装置的结构支架。组装之后 肌动蛋白-肌球蛋白环的收缩导致附着的质膜进入,该质膜将细胞质分成新兴姐妹细胞的两个结构域。收缩过程的力是由运动蛋白肌球蛋白II沿着肌动蛋白的运动产生的。肌球蛋白II使用释放时释放的自由能ATP水解后沿着这些肌动蛋白丝移动,从而使细胞膜收缩形成切割沟。持续的水解导致这种分裂沟进入(向内移动),这是一个惊人的过程,通过光学显微镜可以清楚地看到。
脱落
编辑细胞动力学沟槽进入,直到形成中体结构(由电子致密的蛋白质材料组成),其中肌动蛋白-肌球蛋白环的直径达到约1-2μm。大多数动物细胞类型通过细胞间细胞动力学桥保持连接长达数小时,直到它们被称为脱落的肌动蛋白非依赖性过程分裂,这是细胞分裂的最后一步。脱离的过程在身体上将中身劈成两半。脱落通过从细胞动力学桥去除细胞骨架结构,收缩细胞皮质和质膜裂变而进行。细胞间桥充满了密集的反平行微管束,这些管束来自中心纺锤体。这些微管在中体处重叠,通常被认为是脱落机械的靶向平台。微管切断蛋白spastin造成细胞间桥内微管束解体的主要原因。完全的皮质收缩还需要去除下面的细胞骨架结构。晚期胞质分裂过程中肌动蛋白丝的分解取决于PKCε–14-3-3复合物,该复合物可在犁沟侵入后使RhoA失活。肌动蛋白的拆卸进一步受GTPase Rab35及其效应物磷脂酰肌醇-4,5-双磷酸5磷酸酶OCRL的控制。了解质膜最终分裂的机制需要进一步研究。
定时胞质分裂
编辑必须在时间上控制细胞分裂,以确保仅在正常增殖细胞分裂后期的姐妹染色单体分离后才发生。为了实现这一点,对胞质分裂机制的许多组成部分进行了严格的调节,以确保它们仅能够在细胞周期的特定阶段执行特定功能。细胞分裂仅在APC与CDC20结合后发生。这允许染色体和肌球蛋白的分离同时起作用。
胞质分裂后,随着细胞周期恢复至中间期,非动粒微管重新组织并消失为新的细胞骨架。
植物细胞
编辑由于细胞壁的存在,植物细胞中的胞质分裂与动物细胞中的胞质分裂显着不同,而不是形成收缩环,植物细胞在细胞中部构建细胞板。
细胞板形成的阶段包括:
(1)形成睑板膜,引导和支持细胞板形成的一系列微管;
(2)将囊泡运输至分裂平面并融合形成管状-囊泡网络;
(3)连续融合膜小管,并在call质沉积后转化为膜片,然后沉积纤维素和其他细胞壁成分;
(4)回收细胞板中多余的膜和其他材料;
(5)与亲代细胞壁 融合。
成膜体从残存组装有丝分裂纺锤体,并用作用于贩卖的轨道囊泡到成膜体midzone。这些囊泡包含形成新细胞边界所需的脂质,蛋白质和碳水化合物。电子断层扫描研究已经确定高尔基体是这些囊泡的来源,但其他研究表明它们也含有内吞物质。
然后,这些小管彼此之间扩宽并横向融合,最终形成一个平面的有孔的薄片。随着细胞板的成熟,大量的膜材料通过网格蛋白介导的胞吞作用 被去除。最终,细胞板的边缘通常以不对称的方式与亲本质膜融合,从而完成胞质分裂。其余的窗孔包含穿过它们的内质网链,被认为是纤毛虫 的前体。
新细胞壁的构建始于年轻细胞板狭窄小管的管腔内。很大程度上,通过免疫电子显微镜确定了沉积不同细胞壁成分的顺序。到达的第一个成分是果胶,半纤维素和阿拉伯半乳聚糖蛋白,它们由分泌小泡携带并融合形成细胞板。下一个要添加的成分是call质,call质合成酶在细胞板上直接聚合。随着细胞板的不断成熟并与亲本质膜融合,愈伤组织逐渐被纤维素取代,是成熟细胞壁的主要组成部分。所述中间薄片(胶状层含果胶)从细胞板的发展,服务绑定相邻单元一起的细胞壁。
动物细胞
编辑II型肌球蛋白ATP酶促进细胞动力学沟的进入。由于肌球蛋白被募集到内侧区域,作用在皮质上的收缩力类似于向内拉的“腰包”收缩。这导致向内收缩。质膜通过交联蛋白与皮质紧密结合。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/109098/
