电压门控钙通道
编辑电压门控钙通道(VGCC),也称为电压依赖性钙通道(VDCCs),是在可兴奋细胞(如肌肉、神经胶质细胞、神经元等)的膜中发现的一组电压门控离子通道。对钙离子CA2+具有渗透性。这些通道对钠离子有轻微的渗透性,因此也被称为Ca2+-Na+通道,但它们对钙的渗透性是正常生理条件下对钠的渗透性的1000倍左右。
在生理或静息膜电位下,VGCCs通常是关闭的。它们在去极化的膜电位下被激活(即:打开),这是电压门控加词的来源。细胞外的钙(Ca2+离子)浓度通常比细胞内高几千倍。特定VGCC的激活允许Ca2+流入细胞,这取决于细胞类型,导致钙敏感钾通道激活、肌肉收缩、神经元兴奋、基因表达上调或激素或神经递质释放.
VGCC已在正常和增生的人肾上腺的肾小球带以及产生醛固酮的腺瘤(APA)中进行免疫定位,并且在后一种T型VGCC中与患者的血浆醛固酮水平相关。VGCC的过度激活是兴奋性毒性的主要组成部分,因为细胞内钙水平的严重升高会激活酶,在足够高的水平下,这些酶会降解基本的细胞结构。
电压门控钙通道的结构
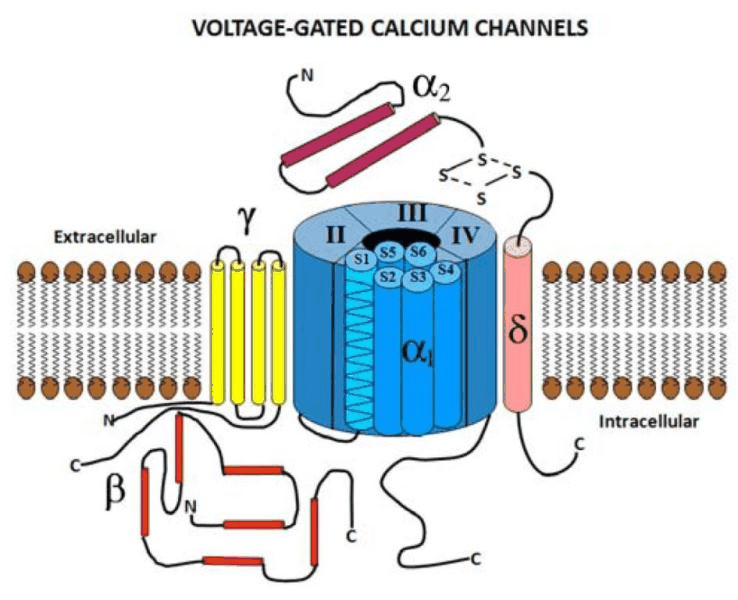
编辑电压门控钙通道由几个不同的亚基组成:α1、α2δ、β1-4和γ。α1亚基形成离子传导孔,而相关的亚基具有多种功能,包括调节门控。
通道子单元
编辑有几种不同类型的高压门控钙通道(HVGCC)。它们在不同类型之间在结构上是同源的;它们都相似,但结构不同。在实验室中,可以通过研究它们的生理作用和/或特定毒素的抑制作用来区分它们。高压门控钙通道包括被ω-芋螺毒素GVIA阻断的神经N型通道,R型通道(R代表抗其他阻断剂和毒素,SNX-482除外)在脑,密切相关的P/Q型通道被ω-agatoxins阻断和二氢吡啶敏感的L型通道,负责骨骼肌、平滑肌和心肌的兴奋-收缩耦合以及内分泌细胞中的激素分泌。
α1亚基
编辑α1亚基孔(分子量约为190kDa)是HVGCC中通道功能所必需的主要亚基,由特征性的四个同源I-IV结构域组成,每个结构域包含六个跨膜α-螺旋。α1亚基形成Ca2+选择性孔,其中包含电压感应机制和药物/毒素结合位点。总共已在人类中鉴定出10个α1亚基:α1亚基包含4个同源结构域(标记为I-IV),每个结构域包含6个跨膜螺旋(S1-S6)。这种排列类似于由电压门控钾通道的单域亚基(每个也包含6个TM螺旋)形成的同源四聚体。电压门控钠通道也共享4域架构(以及几个关键的调节位点,例如C端的EF手和IQ域),这被认为在进化上与VGCC相关。来自4个结构域的跨膜螺旋排列形成适当的通道;S5和S6螺旋被认为排列在内孔表面,而S1-4螺旋在门控和电压传感(特别是S4)中起作用。VGCC会快速失活,这被认为由2个部分组成:电压门控(VGI)和钙门控(CGI)。这些通过使用Ba2+或Ca2+作为外部记录溶液(体外)中的电荷载体来区分。CGI成分归因于Ca2+结合信号蛋白的结合而S1-4螺旋在门控和电压传感(特别是S4)中起作用。VGCC会快速失活,这被认为由2个部分组成:电压门控(VGI)和钙门控(CGI)。这些通过使用Ba2+或Ca2+作为外部记录溶液(体外)中的电荷载体来区分。CGI成分归因于Ca2+结合信号蛋白的结合而S1-4螺旋在门控和电压传感(特别是S4)中起作用。VGCC会快速失活,这被认为由2个部分组成:电压门控(VGI)和钙门控(CGI)。这些通过使用Ba2+或Ca2+作为外部记录溶液(体外)中的电荷载体来区分。CGI成分归因于Ca2+结合信号蛋白的结合钙调蛋白(CaM)到通道上的至少1个位点,因为Ca2+-nullCaM突变体消除了L型通道中的CGI。并非所有通道都表现出相同的调节特性,这些机制的具体细节仍然很大程度上未知。
α2δ亚基
编辑α2δ基因形成两个亚基:α2和δ(它们都是同一基因的产物)。它们通过二硫键相互连接,总分子量为170kDa。α2是与α1亚基相互作用最多的细胞外糖基化亚基。δ亚基有一个跨膜区,胞内部分较短,用于将蛋白质锚定在质膜中。有4个α2δ基因:
α2δ的共表达提高了α1亚基的表达水平,并导致电流幅度增加、更快的激活和失活动力学以及失活电压依赖性的超极化转变。在没有β亚基的情况下观察到其中一些效应,而在其他情况下,需要β的共表达。
α2δ-1和α2δ-2亚基是加巴喷丁的结合位点。该药物类别包括两种抗惊厥药物,加巴喷丁(Neurontin)和普瑞巴林(Lyrica),它们也可用于治疗慢性神经性疼痛。除了对其他目标的作用外,α2δ亚基也是中枢抑制剂和抗焦虑药phenibut的结合位点。
β亚单位
编辑细胞内β亚基(55kDa)是一种细胞内MAGUK样蛋白(膜相关鸟苷酸激酶),包含一个鸟苷酸激酶(GK)结构域和一个SH3(src同源性3)结构域。β亚基的鸟苷酸激酶结构域与α1亚基I-II细胞质环结合并调节HVGCC活性。β亚基有四个已知基因:
据推测,细胞溶质β亚基在稳定最终的α1亚基构象并通过其掩盖α1亚基中的内质网滞留信号的能力将其传递到细胞膜中起主要作用。内质滞留制动包含在α1亚基的I-II环中,当β亚基结合时,它会被掩盖。因此,β亚基最初通过控制在细胞膜上表达的α1亚基的量来调节电流密度。
除了这种运输作用之外,β亚基还具有调节活化和失活动力学以及超极化电压依赖性以激活α1亚基孔的重要功能,因此更多的电流通过更小的去极化。β亚基对与β亚基共表达的非洲爪蟾卵母细胞中心脏α1C的动力学有影响。β亚基作为通道电生理特性的重要调节剂。
直到最近,结构域I和II之间的α1亚基胞内接头上的一个高度保守的18个氨基酸区域(α相互作用域,AID)与β亚基的GK结构域上的一个区域(α相互作用域结合Pocket)被认为是对β亚基的调节作用唯一负责的。最近发现,β亚基的SH3结构域也对通道功能产生了额外的调节作用,开启了β亚基与α1亚基孔具有多重调节相互作用的可能性。此外,AID序列似乎不包含内质网保留信号,这可能位于I-IIα1亚基接头的其他区域。
γ亚基
编辑已知γ1亚基与骨骼肌VGCC复合物有关,但关于钙通道的其他亚型的证据尚无定论。γ1亚基糖蛋白(33kDa)由四个跨膜螺旋组成。γ1亚基不影响贩运,并且在大多数情况下,不需要调节通道复合物。然而,γ2、γ3、γ4和γ8也与AMPA谷氨酸受体有关。
肌肉生理学
编辑当平滑肌细胞去极化时,会导致电压门控(L型)钙通道打开。去极化可以通过细胞拉伸、激动剂结合其G蛋白偶联受体(GPCR)或自主神经系统刺激来实现。L型钙通道的打开导致细胞外Ca2+流入,然后与钙调蛋白结合。活化的钙调蛋白分子激活肌球蛋白轻链激酶(MLCK),使粗丝中的肌球蛋白磷酸化。磷酸化肌球蛋白能够与肌动蛋白细丝形成横桥,平滑肌纤维(即细胞)通过滑丝机制收缩。(有关平滑肌中涉及L型钙通道的信号级联的说明,请参见参考资料)。
L型钙通道也富含横纹肌细胞的t小管,即骨骼肌和心肌肌纤维。当这些细胞去极化时,L型钙通道就像在平滑肌中一样打开。在骨骼肌中,通道的实际打开导致肌浆网(SR)中的钙释放通道(又名兰尼碱受体,或RYR)机械门控,导致RYR的打开。在心肌中,L型钙通道的打开允许钙流入细胞。钙与SR中的钙释放通道(RYR)结合,打开它们;这种现象称为钙诱导的钙释放,或CICR。然而,通过机械门控或CICR打开RYR,Ca2+从SR释放并能够与肌动蛋白丝上的肌钙蛋白C结合。然后肌肉通过滑动丝机制收缩,导致肌节缩短和肌肉收缩。
开发过程中的表达变化
编辑在发育早期,有大量的T型钙通道表达。在神经系统成熟过程中,N型或L型电流的表达变得更加突出。因此,成熟的神经元表达更多的钙离子通道,只有在细胞明显去极化时才会激活这些钙离子通道。低电压激活(LVA)和高电压激活(HVA)通道的不同表达水平也可以在神经元分化中发挥重要作用。在发育中的非洲爪蟾脊髓神经元中,LVA钙通道携带自发的钙瞬变,这可能是神经元采用GABAergic所必需的。表型以及过程产物。
临床意义
编辑电压门控钙通道抗体与LamBERT-Eaton肌无力综合征有关,也与副肿瘤性小脑变性有关。
电压门控钙通道也与恶性高热和蒂莫西综合征有关。
在Cav1.2基因的第三个内含子中具有单核苷酸多态性的CACNA1C基因突变与称为Timothy综合征的长QT综合征变体以及Brugada综合征有关。大规模遗传分析表明,CACNA1C可能与双相情感障碍有关,随后也与精神分裂症有关。此外,CACNA1C风险等位基因与双相情感障碍患者的大脑连接中断有关,而在其未受影响的亲属或健康对照中则没有或仅在轻微程度上。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/135368/
