什么是吡啶合成
编辑Kröhnke吡啶合成是有机合成中α-吡啶甲基酮盐和α,β-不饱和羰基化合物之间的反应,用于生成高功能的吡啶。吡啶类化合物广泛存在于天然和合成产品中,因此人们对其合成路线有广泛的兴趣。该方法是以FritzKröhnke命名的。
反应的发展发现
编辑在吉森大学的工作中,Kröhnke观察到α-吡啶鎓甲基酮盐1与α,β-不饱和羰基化合物2通过迈克尔反应缩合,当用乙酸铵处理时,在温和的反应条件下高产率得到2,4,6-三取代的吡啶类。拟议的中间体1,5-二羰基化合物3还没有被分离出来。自发现以来,Kröhnke合成法在制备二、三和四吡啶衍生物方面享有广泛的适用性,与Hantzsch吡啶合成法等相关反应相比,显示了许多优势。机制Kröhnke吡啶合成的机制始于α-吡啶甲基酮4的烯化,然后1,4-加到α,β-不饱和酮5,形成Michael加合物6,后者立即同化为1,5-二羰基7。向7加入氨,然后通过8进行脱水,生成亚胺中间体9,然后亚胺中间体被去质子化为烯胺10,并与羰基环化生成中间体11。吡啶阳离子随后被消除,形成羟基二烯胺12。12通过随后的失水进行芳香化,生成所需的吡啶杂环13。
试剂合成和反应条件
编辑克伦克合成法的起始材料通常很容易制备,从而使该方法更加方便和广泛。通过用吡啶处理相应的溴甲基酮,可以很容易地制备出α-吡啶鎓甲基酮盐。α,β-不饱和酮通常可以从市场上买到,或者可以用一些已知的方法来制备。此外,曼尼希碱也可用作该方案的迈克尔受体,进一步扩大了可纳入Kröhnke方案的起始材料的范围。克伦克合成的反应条件一般都很简单,反应的产率也很高,反应温度一般不超过140℃。Kröhnke合成通常在冰醋酸或甲醇中进行,但它也可以在水溶液条件下进行,最近还可以在无溶剂条件下进行。1,3-二羰基化合物也被证明是代替α-吡啶甲基酮盐的可行的起始材料。例如,用乙醇中的碱处理1,3-二酮14,然后用乙酸铵、乙酸、相应的烯酮和一种路易斯酸处理,可以得到形式为15的3-酰基三芳基吡啶。这些酰基吡啶是有吸引力的中间体,因为它们有一个亲电的手柄,可以将额外的功能纳入分子中。这允许直接构建复杂的多芳基系统,这是一种有吸引力的方法,用于含有功能化吡啶分子的药物目标的库合成。
与其他方法相比的优势
编辑用于制造吡啶的Kröhnke合成法与其他方法相比具有许多简洁的优势。与Hantzsch合成法不同,Kröhnke方法不需要通过氧化来生成所需的产品,因为α-吡啶甲基酮已经具备了正确的氧化状态。克伦克合成法的另一个优点是其高原子经济性。例如,Chichibabin合成法需要2个当量的不饱和起始材料。此外,Kröhnke合成法的副产品是水和吡啶,这使得工作和纯化协议变得容易。与可比的吡啶合成方法不同,克伦克合成法得益于它是一种高产的单锅合成法,这最终使得合成途径得到简化,并进一步简化了组合库的编目。
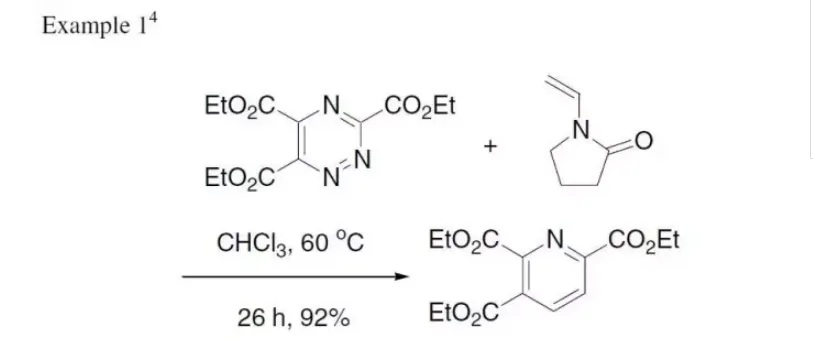
范围和局限性
编辑克伦克吡啶合成法的广泛范围使其对包括吡啶基、噻吩基和呋喃基分子在内的多芳基系统的合成特别有用。该方法可以容忍α-吡啶甲基酮片段和α,β-不饱和羰基化合物上的一系列广泛的芳基取代物,因此可用于生成广泛的多芳基系统。此外,进入的芳基取代基上的电子抽出基团和电子捐献基团都能很好地被容忍。Kröhnke合成法也可以使用烷基和乙烯基取代基,从而获得中等至良好的产量。由于其范围广泛,Kröhnke方法已被广泛用于合成双吡啶(16)、三联吡啶(17)、四联吡啶(18)、三联苯(19)和三联苯(20)。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/160556/
