热能(Thermal energy)指构成物质的分子或原子是以无规则的形式不断运动的,由不相互碰撞的分子或原子的无序运动产生的能量称为物质的热能。温度越高,原子和分子的运动就越剧烈,物质具有的热能就越大。
定义
编辑微观热能
从微观角度来看,热能是物体内部所有分子作无规则的热运动的动能与分子内部原子振动的动能之和,即热能=分子平动和转动的动能+原子振动的动能。热能和内能并不等同,只有对不计分子间的相互作用力和分子势能的理想气体,热能和内能才等同。在温度为
的理想气体下热能的变化:
式中
为气体的质量,
为摩尔质量,则
为摩尔数,
为分子的能量自由度数,
为定容摩尔热容量。
宏观热能
从宏观角度来说,热能的体现就是物体温度的高低,热能反映了组成物质的原子或者分子微观运动的剧烈程度,运动的剧烈程度越强,物体所蕴含的热能就越多,其温度就越高。从宏观分析,热能和机械能在传递和转换时,能量的总量必定守恒。这就是热力学第一定律的简单表述,即
,其中
表示内能的变化量,
表示外界对系统所做的功,
表示系统从外界吸收的热量,它建立了热力过程中的能量平衡关系。
研究历史
编辑古希腊时代一直以来都有热质说和热动说两种观念,其中热质说的代表性人物是布莱克、伽桑狄,认为热是一种没有重量的特殊流体物质,数量是守恒的,热质粒子之间相互排斥,但却受到普通物质粒子的吸引,而且不同的普通物质对热流体的吸引力不同;另外一种是以培根、笛卡儿为代表的热动说,认为热是组成物质的微观粒子运动的表现,它可由物体的机械运动转化而来。
起源
整个十八世纪,热质说和热动说这两种观念都存在。1798年,本杰明·汤普森(Benjamin Thompson)在英国皇家学会上发表了《关于用摩擦产热的来源的调研》一文。1799年,汉弗里·戴维(Humphry Davy)做了著名的摩擦两块冰,可以融化为水的实验。这个实验质疑了热作为一种物质的存在。但是当时这两个实验并没有受到重视。直到十九世纪,1822年,法国数学家傅立叶(Jean Baptiste Joseph Fourier)出版了专著《热的解析理论》用数学理论,从现象出发建立关于热的普遍理论,集中解决了热在非均匀加热的固体中的分布传播的问题。1824年卡诺发表了《谈谈火的动力和能发动这种动力的机器》这本书,卡诺在这部著作中提出了“卡诺热机”和“卡诺循环”的概念及“卡诺定理”。卡诺定理涉及热能和功的相互转换问题,也涉及热功当量、热力学第一定律及能量守恒与转化的问题,还包含了热力学第二定律的若干内容。这两部著作都不同程度上以热质说的观点为基础。热力学第二定律建立以后,人们对热运动的本质进行了研究,并在此基础上提出了分子运动理论,这为微观层面上的热能研究奠定了基础。
发展
1847年,詹姆斯·普雷斯科特·焦耳(James Prescott Joule)在一次演讲中描述了与热能和热量相关的术语,他将热的形式定义为显热(sensible heat)和潜热(latent heat),它们分别影响粒子的动能和势能,最终得出了热和功可以按固定比例进行互换的这个结论,同年赫尔曼·冯·亥姆霍兹(Hermann von Helmholtz)也基于永久运动不可能这样的抽象思维得出了相同结论。1848年6月,开尔文发表了著名论文《在卡诺热动力学理论基础上和从雷诺的观察进行计算的绝对温标》一文,正式提出了绝对温标。这种温标主要用来作为物理判据的标准,它也可以作为实际温度计的标准。1905到1908年间,爱因斯坦和佩兰的研究工作之后,整个科学界才接受存在原子和分子的观念。阿尔伯特·爱因斯坦对布朗运动的解释进一步证实了分子运动理论,并用微观领域的观点解释了宏观现象,让热能的微观和宏观角度互通。1954年,国际计量大会规定水的三相点的温度为273.16K,这样定出的热力学温度的单位K(开尔文),这个温度就是水的三相点的热力学温度。
相关概念
编辑内能
物体内所有分子做无规则运动的分子动能和分子势能的总和叫做物体的内能。任何一个物体都是处于一定的状态中,以气体为例,气体状态主要用压强、体积和温度这三个状态参量表示当蒸汽机气缸中被压缩的水蒸汽的压强大于外部压强时可以推动活塞对外做功。在做功的过程中其状态发生变化,这说明处于一定状态的水蒸汽具有做功的本领,即具有能量,这显然不是机械能而是另一种形式的能,是由物体内部的状态决定的能,我们称其为内能。物体内能的大小与物体的种类、质量、温度、状态等多种因素有关, 内能大的物体温度不一定高, 内能小的物体温度不一定低若内能大的物体的温度低于内能小的物体,这两个物体相接触时, 热量只能从内能小的物体自动传给内能大的物体。从分子运动论观点看,热能的本质是物体内部所有分子动能之和,而内能除包括物体内部所有分子的动能之外,还包括分子间势能的总和,以及组成分子的原子内部的能量、原子核内部的能量、物体内部空间的电磁辐射能等。
温度
温度是表示物体冷热情况的一种标志。物体受热,温度上升;物体受冷,温度下降。反之,物体温度升高,表示它吸热;温度降低,表示它放热。因此,根据温度可以判断热量传递的方向,而热量总是从高温处传向低温处。温度是表示物体冷热程度的物理量,从微观上来讲温度是反映了物体分子热运动的剧烈程度,是物体分子平均动能的标志温度是大量分子热运动的集中体现。温度是物体分子平均动能大小的标志,两个相接触的物体热传递的过程是高温物体大量动能大的分子与低温物体大量动能小的分子相碰撞,发生能量交换,前者动能减小后者动能增加直至动能趋于一致达到动能平衡,这时两个物体的温度相同。
温标
用来度量温度高低而规定的标尺称为温度标尺,简称温标。为了定量地确定温度,对物体或系统温度给以具体的数量标志,各种各样温度计的数值都是由温标决定的。为量度物体或系统温度的高低对温度的零点和分度法所做的一种规定,是温度的单位制。

华氏温标与摄氏温标
最早建立的温标是华氏温标、摄氏温标,这些温标统称为经验温标。它们的缺陷是温度读数与测温物质及测温属性有关,经验温标现已废弃不用。为了统一温度的测量,温度的计量工作中采用理想气体温标为标准温标。规定温度与测温属性成正比关系,选水的三相点为固定点。国际单位制中采用的温标,是热力学温标。它的单位是开尔文,中文代号是开,国际代号是K。
化学能
化学能是在化学反应中能发生改变的那部分物质的内能,化石燃料燃烧、炸药爆炸、食物在动物体内发生化学变化,这些在化学变化中释放出的能,表现形式上可以是热能、光能、电能等,都源于物质发生化学变化时内能的改变。绿色植物的光合作用,太阳光的光能通过光合反应,转化为碳水化合物的内能,这部分内能在碳水化合物发生氧化反应转化为水和二氧化碳时,可以释放出来,都是化学能的范畴。
比热容
比热容是热力学中常用的一个物理量,是单位质量的物质温度升高(或降低)1K(或1°C)时所吸收(或放出)的热量。测量物质比热容的方法有混合法、冷却法、物态变化法、电流量热法。根据物量计量单位的不同,比热容分为质量比热容C、单位为
,摩尔比热容
、单位为
,体积比热容
、单位为
。其中最常用的是质量比热容,摩尔比热容次之。比热容与升温过程的条件有关,分别有定压条件和定容条件下测量的热容,其数值不同,对气体尤为显著,但对固体材料则几乎无差异,所以通常只测比定压热容(
)。
开尔文
开尔文是热力学温标或称绝对温标,是国际单位制中的温度单位。开尔文温度常用符号K表示,其单位为开。英国物理学家开尔文指出,温度每降低一度,随之降低
的是物质分子的平均内能,即在-273.16℃时,物体的内能为零,分子运动完全停止,开尔文把-273.16℃定义为绝对零度。
相关定律
编辑热力学定律
热力学第零定律
两个系统分别与处于确定状态的第三个系统达到热平衡,这两系统之间也将处于热平衡。该定律也被称为热平衡定律。该定律由福勒(Fowler)在1939年提出。热力学第零定律告诉我们,互为热平衡的热力学系统具有一个数值相等的状态函数,该状态函数被定义为温度。热力学第零定律提供了判断两系统接触是否达到热平衡的依据,以一个确定温度的系统为标准,与之接触后状态不变的系统温度相同,状态变化的系统温度不同,于是可以判断相互接触的两系统温度是否相同,但无法判断二者温度谁高谁低,想要准确测量温度,还需借助温度计。

热平衡说明
热力学第一定律
当热能在与其他形式能量相互转换时,能的总量保持不变。该定律也被称为能量守恒定律。热力学第一定律是能量转换和守恒定律在热力学中的应用,它用来确定热力过程中各种能量在量上的相互关系。热力学第一定律指出热能作为能量,可以与其他形式的能量相互转换,但在转换过程中能量总量保持不变。热力学第一定律的能量方程式是热力学中最基本的方程式之一,对于任何热力系统,能量平衡关系可表述为:输入系统的能量 – 系统输出的能量 = 系统储存能量的变化封闭系统的热力学第一定律的表达式为:
(
表示外界输入系统的净热量;
表示系统热力学能的变化;
表示系统输出的总功)在通常情况下,封闭系统宏观运动的动能和位能的变化可忽略不计,系统储存能量的变化只有热力学能的变化。稳定流动系统的热力学第一定律的表达式为:
(
表示输入系统的净热量;
表示流体带出的焓[hán]值与带人的焓值之差;
表示技术功,可理解为技术上可利用的功)稳定流动是指流道中任何位置上流体的流速及其他状态参数(包括温度、压力、比体积等)都不随时间发生变化的流动。在工程应用中,大部分能量转换装置中的工质常处于稳定流动的状态。
热力学第二定律
热力学第二定律指出自然界进行的能量转换过程是有方向性的,过程总是自发地朝着一定的方向进行,如水总是自发地从高处向低处流动。由于热力学过程普遍存在于各类工程实践中,因此,热力学第二定律的应用范围极其广泛,其表述方式也形式多样。但所有的表述方式所表达的实质是共同的、一致的,因而不同的表述方式都是等效的。下面列举两种热力学第二定律常见的表述。克劳修斯表述:热量不能自发地从低温物体传到高温物体。开尔文表述:不可能从单一热源吸收热量,使之完全变成功,而不产生其他影响。人们常把能通过从单一热源取热,使之完全变成功而不引起其他变化的机器叫做第二类永动机。热力学第二定律也可表述为第二类永动机是不可能制成的。
热力学第三定律
不可能通过有限的循环过程,使物体温度冷到绝对零度,即绝对零度不可能达到。这个定律根据1912年能斯特提出的“绝对温度不可能达到”这一推论得出。从分子动力学角度分析,温度代表着微观粒子热运动的平均动能,绝对零度不能达到也就意味着系统中的微观粒子始终处于热运动之中。在历史上,热力学第三定律是从大量实验事实中总结出来的,作为经验规律,它与热力学第一、第二定律共同构筑了热力学整个逻辑基础的公理化原理体系。从统计学的观点来看,热力学第三定律是物质微观运动的量子力学本性。随着人们在低温领域的实践探索,热力学第三定律背后蕴藏的含义被不断发现。它让人们开始了解低温世界,而且还把低温和低熵联系到一起,使人们能够观测到超导体和超流体现象。
能量均分定理
在热平衡状态下,物质(气体,液体和固体)分子的每一个自由度都具有相同的平均动能,在温度T下其数值为
(k是玻耳兹曼常数,T是绝对温度)。自由度是指完全确定一个物体的空间位置所需要的独立坐标数目。能量均分定理是指在相对系统静止的参考系中,分子的平均元规则动能是按自由度平均分配。能量均分定理是经典力学中的一条重要的统计规律,适用于大量分子组成的系统,包括气体和较高温度下的液体和固体,适用于分子的平动、转动和振动,经典统计物理给出定理的严格证明。
热能的来源
编辑热能既可以直接获得,也可以通过能量转换获得,前者是将太阳和地热等所提供的热能加以收集后直接使用,后者则是将蕴藏于燃料中的核能或化学能经适当转换而获得。其他形式的能量(如化学能、核能等)都可以很容易地转换为热能而得到利用,但其必须遵循相关的能量转换原理。

其他形式的能量
太阳能
太阳内部持续不断地进行着由氢聚变成氨的核聚变反应,同时其不断地以光线的形式向广阔宇宙空间辐射出巨大的能量,即太阳能。在该反应过程中,太阳内部产生数百万摄氏度的高温,表面温度达5762K,这正是太阳向空间辐射出巨大能量的源泉,地球所接收到的太阳能相当于全球所需能量的3万~4万倍,其总量是现今世界上可以开发利用的最大能源量。对人类来说,太阳能是一种无限的能源,太阳能的研究和应用是今后人类能源的发展方向。
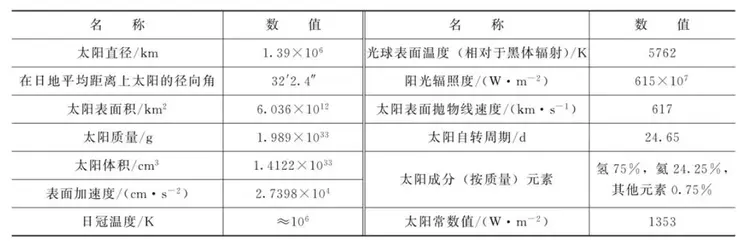
太阳的物理数据
化学能
化学能转换为热能是人类利用热能最为古老的方式,也是迄今为止仍为主导的用能方式。化学能通常存储于燃料中,通过燃料的燃烧来实现化学能转换为热能。燃料按形式可分为固体燃料、液体燃料和气体燃料。天然固体燃料包括煤炭和生物质等,煤炭是世界上储量最多的天然燃料。天然固体燃料可通过加工变为人工固体燃料,如焦炭、型煤和木炭等。天然液体燃料即石油。原油通过加工变为人工液体燃料,如汽油、煤油、柴油和重油等。汽油和柴油通常用于发动机,重油用于燃煤锅炉点火或低负荷稳燃。天然的气体燃料包括天然气 (natural gas)、煤层气、页岩气 (shell gas)等,人工气体燃料来源于煤和石油的加工,包括:焦炉煤气、高炉煤气、水煤气和液化石油气等。气体燃料主要用于民用、燃气锅炉、窑炉、燃气轮机以及燃煤锅炉等。
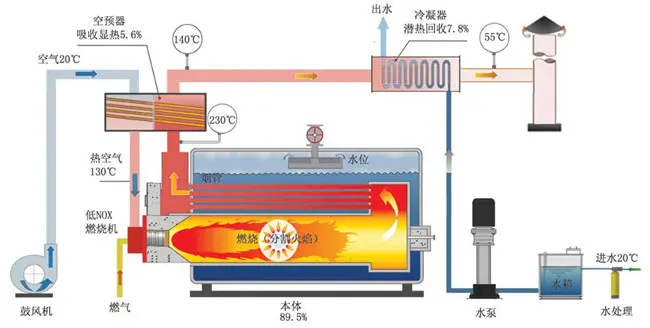
燃煤锅炉
核能
核能获得的途径主要有两种,即核裂变与核聚变。核裂变的使用已经达到工业应用规模;而核聚变即受控热核反应,需要在1亿摄氏度的高温下才能进行,由于所需条件十分苛刻,所以迄今尚未实现工业化和大规模应用的水平。核能具有环境影响小、能量密度高、经济性良好、安全性能高等特点,日渐成为人类使用的重要能源之一,逐渐成为工业能源的重要组成部分。

核电站
地热能
地热是来自地球内部的高温热能,地球刚形成的时候,温度非常高,随着时间的推移,地表逐渐冷却,但它内部仍然保留着大量的热能。与此同时,地球内部存在着很多放射性同位素,它们无时无刻不在产生热量,不断地加热着地球。地球是内部可以分为三层:地壳、地幔和地核。从地表往下到地壳、地幔再到地核,温度逐渐升高,在地核处甚至能达到6000°C以上,地球内部存在着各式各样的热,有自转热、重力热、化学热和放射热等。这些热源源不断地从地球内部一层层、一圈圈向外传递到地壳中,成为广泛存在于地球各处的地热资源。与其他能源相比,地热不受地域、季节、昼夜等因素限制,能够为人类提供稳定的能源供给。地热能被认为是一种可再生的清洁能源。

利用地热能发电
生物能
生物能从生物获得的能量。生物能是一种间接的太阳能,地球上大量的绿色植物通过光合作用,将太阳光能转化为生物能存贮于有机物中。每年地球上的绿色植物经光合作用生成的生物能量约为全球耗能的3-8倍。通过直接燃烧的方式可以将植物的生物能转化为热能。

通过燃烧植物转化
传递方式
编辑热传递是指由于温度差引起的热能传递现象。热传递中用热量量度物体内能的改变。热传递主要存在三种基本形式:热传导、热辐射和热对流。
热传导
热量从物体温度较高的一部分沿着物体传到温度较低的部分的方式叫做热传导。它是通过物质内部的分子间相互碰撞和振动传递热能的过程。当物体的一部分受热时,分子会获得能量,并传递给周围的分子。这个过程在固体中最为显著,因为固体的分子相对稳定地排列在一起,便于热能的传递。热传导的速度取决于物质的导热性能和温度差异。热传导的条件是相邻物体之间,或同一物体的不同区域具有温度差,形成温度梯度。其微观机制是固体岩石通过内部晶格质点的热振动来进行热传导,对于不流动的流体则通过分子的热振动来层层传递热量,在金属物体中主要是由自由电子的热振动而引起热传导。这些传导在高温下还有明显的电磁辐射形式的热传递,这些热传递过程都没有物质转移。
热对流
热对流是指通过流体(气体或液体)的对流运动将热能传递的过程。当流体受热并膨胀时,其密度减小,从而形成一个升温的热量区域,该区域会上升并向上边界移动。同时,冷却的流体下沉并形成冷区。通过这种对流运动,热能得以从热区传递到冷区。对流传热的速度取决于流体的性质、密度差异和运动的强度。热对流现象在自然界广泛存在,例如地下热液的活动,岩浆的活动,海洋热流的活动,地幔岩浆的运动等。

洋流图
热辐射
物质中的分子、原子和电子的振动、转动等运动状态的改变,会辐射出频率较高的电磁波,这类电磁波覆盖了较宽的频谱范围,包括可见光与部分红外光区域,这部分辐射线称为热射线。热射线的传递过程称为热辐射。当热射线照射到物体表面时,一部分被吸收,一部分被反射,还有一部分穿过该物体。热辐射是指通过电磁辐射传递热能的过程,热能以电磁波的形式从热源辐射出去,并在空间中以光的速度传播。这种传热方式不需要介质的存在,可以在真空中传递热能。辐射传热的速度取决于热源的温度和物体的辐射特性。
热能的转换
编辑热能是人类使用最广泛的能源形式,几乎所有的能源都要转换成热能才能为人类所用,或者再转换成其他形式的能量予以利用。在实际的能源利用过程中,大量的能源首先转换成热能,热能再通过热机、热电、热反应器、黑体辐射等方式转换为机械能、电能、化学能和光能再加以利用,如下图所示。

热能转换利用路径
热电转换
热电转换是利用材料的热电效应或热电耦合效应,在温度差的作用下,将热能转换为电能。全球约有80%的电站利用热能发电。以热电材料为核心的热电转换技术可不依靠任何外力将“热”与“电”两种不同形态的能量直接转换,备受科学界和工业界的关注。不同于通常的介质转换的方式,理论上热电材料的热能利用效率可无限接近卡诺循环,但是实际的材料仍然低于10%,这也是限制大规模应用的主要原因。
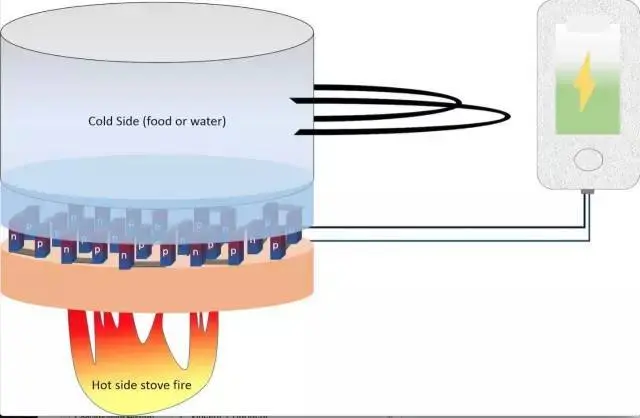
热电转换原理
热能机械能转换
热能机械能转换的基本原理是通过燃烧或燃料氧化反应释放出的热能驱动工作物质(如气体或液体)进行膨胀,从而产生机械力,并通过传统的机械结构将机械力转化为旋转运动或线性运动,最终实现机械能的输出。机械能是一种高品位的能量形式,因为它能全部不计损耗地转换为热能。热能转换为机械能一般要借助热机,能将燃料的化学能转换为机械能的热机。最为直接的就是内燃机及燃气轮机,将燃料通过燃烧设备转换为燃烧产物的显热,再通过换热转化为蒸汽中的热量,再由蒸汽去推动蒸汽或汽轮机得到机械能。
化学能热能转换
化学能转换为热能的原理基于化学反应过程中能量的释放。在化学反应中,原子或分子之间的化学键被断裂或重新排列,形成新的化学物质。如果一个化学反应释放的能量大于其吸收的能量,这个过程就是放热反应。在放热反应中,多余的能量以热的形式释放,从而将储存在化学键中的能量转化为热能。这种能量转换在自然界和人类活动中非常普遍,如燃烧燃料、生物体内的新陈代谢过程等。
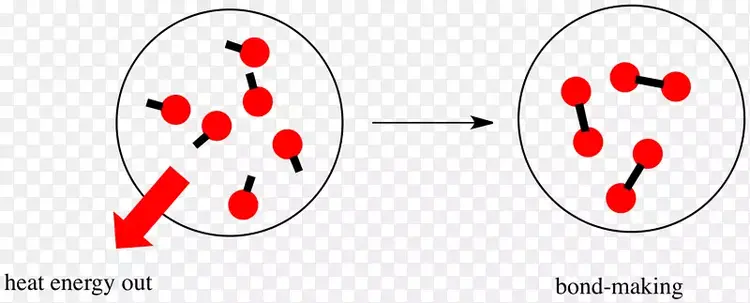
放热反应
应用
编辑电力行业
热能在电力行业最大的用途就是发电,可以利用燃料、核能或太阳能等能源产生高温高压的蒸汽,进而驱动涡轮发电机发电的技术。主要的热能发电技术包括燃煤发电、燃气发电、核能发电、太阳能发电等。通过固体、液体、气体等燃料的燃烧将化学能转化为热能,再用动力机械转换为机械能驱动发电机发电的工厂称为火力发电厂,简称火电厂。其中完成上述能量转换过程的设备组合称为火力发电机组。

塔式太阳能热发电站
航空航天
热能在航空航天领域的用途就是为火箭升天提供动力,火箭发动机最大的零件就是喷管,火箭的喷管的主要作用是将火箭推进剂燃料产生的高温、高压气体的热能转化为动能,从而让火箭获得巨大的推力。而火箭发动机正是应用了热能动力系统,将热能转化为机械能,从高温热源处获得热量,在高温高压的情况下产生膨胀,并将循环的废热进行排除,热能系统的高温热源主要来自于矿物燃料,产生热能

直径2.5米级的再生冷却喷管
建筑供暖
热能如地热能可以直接用于供暖,比如中国的北方地区通过地热能的直接开采用于居民生活供暖供热,也有直接利用出露地表或在地下作深循环的对流型地热资源,即为日常所见的温泉。浅层和中深层地热供暖规模均将实现进一步快速增长。地热清洁供暖对碳减排和大气污染防治效果十分突出,且地热供暖在无补贴的条件下已具备较煤炭、燃气、电供暖的价格优势。
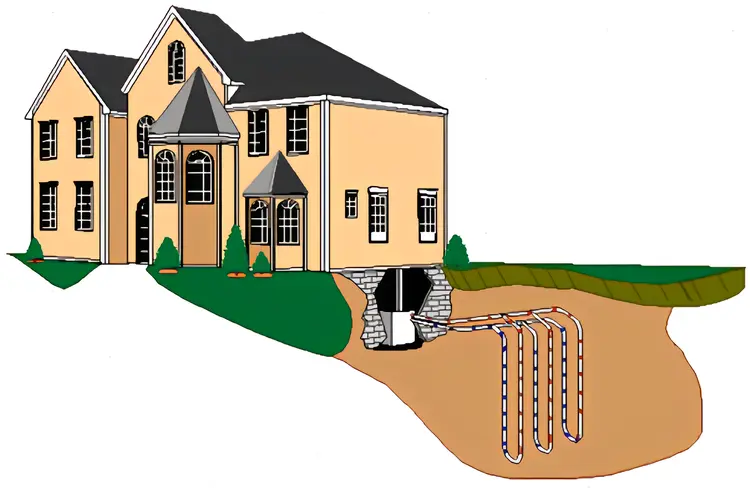
地热供暖系统
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/587211/
