- ▪ 硝酸
- ▪ 与磷、氧化钙反应
- 3 制备方法
- ▪ 三氧化二铁还原制备法
- ▪ 铁粉还原法
- ▪ 氢气还原法
- ▪ 热分解制备法
- 4 测定方法
- ▪ 邻菲罗啉分光光度法
- ▪ 重铬酸钾直接滴定法(氧化还原滴定法)
氧化亚铁(英语:ferrous oxide),又称为一氧化铁、黑色氧化铁、氧化铁(Ⅱ)和氧铁,是铁的氧化物之一,分子式为FeO,摩尔质量为71.85 g/mol,无天然矿物存在,常温下,氧化亚铁外观呈现为黑色立方晶系结晶或粉末,不溶于水、乙醇和碱性溶液,但可溶于酸 ,温度低于198 K时表现为反磁性。此外,氧化亚铁为强碱性物质,当冷却到830 K以下时,氧化亚铁会发生歧化反应生成磁铁矿(四氧化三铁)和铁。化学性质活泼,极易被空气(氧气)氧化,甚至发出激烈强光生成三氧化二铁,加热时,又可迅速被空气(氧气)氧化为四氧化三铁。
物质结构
编辑氧化亚铁的晶体结构氧化亚铁为黑色的氯化钠型立方晶系结晶,结构疏松多孔,为了形成最紧密堆积,保持氧化亚铁晶体的电中性,通常部分Fe²⁺会转化为Fe³⁺,从而使得氧化亚铁晶体偏离理想配比,即氧原子数多于铁原子,而不是以1:1的理想配比存在,由于氧化亚铁中的氧原子数总是多于铁原子,因此常以“FeO”、FexO(x<1)或FeOn(n>1)的形式来表示氧化亚铁。氧化亚铁这种非理想配比也使得其氧含量在22.27%到23.92%之间变化,相应的晶格常数也在0.4301nm到0.42816nm之间变化,这时相对密度从5.728变化到5.613。在真空中加热到800℃以上可使部分氧化亚铁发生分解反应,生成铁单质和氧气,这一过程使得氧化亚铁层中掺杂进部分铁电子,从而构成原子(n型)半导体发射层结构,使其发射性能优于纯铁。在温度低于198 K时,氧化亚铁的晶体结构会发生微小变化,导致其具有反铁磁性。
理化性质
编辑氧化亚铁为碱性氧化物,外观呈现为黑色立方晶系结晶或粉末,可含2个或4个结晶水,相对密度为5.7 ,熔点为1377 ℃,温度低于198 K时表现为反铁磁性,不溶于水、乙醇和碱性溶液,但可溶于酸,生成亚铁盐,当温度低于570℃时,氧化亚铁具有热不稳定性,容易分解为 α-Fe 和四氧化三铁,但从570 ℃骤冷时能够抑制该分解反应的发生速度,当温度升至3414℃时氧化亚铁开始气化并发生分解反应,生成铁单质和氧气。
分解反应
当在真空中加热到800℃以上时,可使部分氧化亚铁发生分解反应,生成铁单质,并放出氧气。反应的表达式如下:
歧化反应
当温度低于830K时,氧化亚铁可发生歧化反应生成磁铁矿(四氧化三铁)和铁。反应的表达式如下:
与水反应
氧化亚铁不溶于水,但当温度升至350℃时,可与水发生反应,生成四氧化三铁,并放出氢气。反应的表达式如下:
与非金属单质反应
碳
在转炉内,氧化亚铁可与碳单质发生反应生成铁单质,并放出一氧化碳气体,该反应为放热反应。在高炉内,则需加热至950℃以上才可发生该反应。反应的表达式如下转炉内:
高炉内:
硅
氧化亚铁可与硅反应得到铁单质和二氧化硅,该反应为吸热反应。反应的表达式如下:
磷
氧化亚铁可与磷发生反应,生成铁单质和五氧化二磷,该反应为吸热反应。反应的表达式如下:
与金属单质反应
锰
氧化亚铁可与锰发生反应,生成铁单质和氧化锰,该反应为吸热反应。反应的表达式如下:
铝
氧化亚铁可与金属铝发生反应,生成铁单质和氧化铝,该反应为吸热反应。反应的表达式如下:
与非金属单质氧化物反应
一氧化碳
常温下,氧化亚铁与一氧化碳反应生成Fe₃、二氧化碳和一氧化碳。当加热至950℃以上时,产物中的Fe₃转变为Fe,同时,二氧化碳含量减少,一氧化碳含量升高。该反应为吸热反应。反应的表达式如下:
二氧化碳
氧化亚铁为强碱性物质,能够迅速吸收二氧化碳,与其反应生成四氧化三铁和一氧化碳。反应的表达式如下:
二氧化硅
氧化亚铁可与二氧化硅发生反应,生成硅酸铁,该反应为放热反应,反应的表达式如下:
五氧化二磷
氧化亚铁可与五氧化二磷发生反应,生成磷酸铁,该反应为吸热反应,反应的表达式如下:
与酸反应
盐酸
氧化亚铁可溶于盐酸,并与盐酸发生反应,生成氯化亚铁和水,反应的表达式如下:
硫酸
氧化亚铁可溶于硫酸,并与稀硫酸反应生成硫酸亚铁,但当反应体系中有磷酸参与反应时,则会生成硫酸铁。反应的表达式如下:
硝酸
氧化亚铁可溶于硝酸,常温下,氧化亚铁与硝酸反应生成硝酸铁和二氧化氮,但当加热时,氧化亚铁则与稀硝酸反应生成硝酸铁、一氧化碳和水。反应的表达式如下:
与磷、氧化钙反应
在高温条件下,氧化亚铁可与磷单质和氧化钙反应生成铁单质和磷酸钙,该反应为吸热反应。反应的表达式如下:
制备方法
编辑氧化亚铁没有天然产品,只能通过人工合成制备。
三氧化二铁还原制备法
铁粉还原法
该方法通过在900℃时加热使三氧化二铁和铁粉(使用前需在一定温度下用气体除去铁粉表面的氧化膜)发生反应来制备氧化亚铁,制备过程中通过向反应体系中通入氩[yà]气以排除体系内空气,防止氧化亚铁被进一步氧化。
(1)
(2) 但由于(1)式中得到的磁铁矿(四氧化三铁)呈稳定状态,所以式(2)的反应难以进行,进而导致铁粉用量远大于理论的化学计算量,以及生成的氧化亚铁纯度较低,含有四氧化三铁和金属铁等杂质。
氢气还原法
该方法通过向三氧化二铁中通入氢气,使其发生还原反应生成氧化亚铁。还原过程通常在700~800℃之间进行。在827℃时,其平衡常数(即,K=P(水)/(氢气))为2.74,而在同样温度下由氧化亚铁还原金属时的平衡常数为 0.504。因此在上述温度下制备氧化亚铁时,水蒸气与氢气的浓度比应控制在2.74~0.504之间。
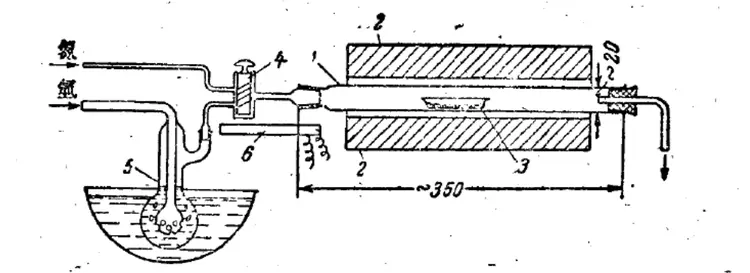 氢气还原三氧化二铁制备氧化亚铁的仪器(1.反应(管);2点燃;3.盛三氧化二铁的船;4.三通活塞:5.盛水洗瓶;6.电热器)
氢气还原三氧化二铁制备氧化亚铁的仪器(1.反应(管);2点燃;3.盛三氧化二铁的船;4.三通活塞:5.盛水洗瓶;6.电热器)
热分解制备法
该方法利用草酸亚铁在隔绝空气条件下发生热解反应制备氧化亚铁。即,先将草酸亚铁(FeC₂O₄•2H₂0)在真空中加热使其充分脱水后,将脱水后的试样(FeC₂O₄)装入铁坩[gān]埚中,并将铁坩埚放到反应管中,加热使其发生热分解反应,即可制得氧化亚铁。制备过程中通过向反应体系中通入氩气以排除体系内空气,防止氧化亚铁被进一步氧化。
通过上述热分解反应产生的气体为混合气体(CO:CO₂ =1:1 ),可提供无氧环境,进一步防治氧化亚铁被氧化。可以通过将分解产生的气体尽快排出,使氧气分压处于低真空状态或在惰性气体流通的情况下进行反应等方法加速该制备过程。该方法制得的氧化亚铁的纯度高,并且经过X射线测试,证明得到的生成物(方铁矿)与氧化亚铁非常相似。当温度低于570℃时,氧化亚铁为不稳定相,容易分解为 α-Fe 和Fe₃O₄,但从 570℃ 骤冷时却能够抑制氧化亚铁的分解。因此,不论利用何种方法制备氧化亚铁,均要注意及时冷却,否则生成物中容易带有 α-Fe 和Fe₃O₄,使氧化亚铁纯度降低。
测定方法
编辑邻菲罗啉分光光度法
该方法通过将试样经硫酸-氢氟酸处理后制成溶液,利用其在pH=3~9的溶液中,邻菲罗啉与二价铁离子发生的显色反应具有很强的选择性,而且生成的红色配合物非常稳定,在510 nm(可见光)处具有最大吸收峰的特点,通过测定待测试样溶液的吸光度可以得到氧化亚铁的含量。
重铬酸钾直接滴定法(氧化还原滴定法)
该方法将含有氧化亚铁的待测试样用氢氟[fú]酸-硫酸混合溶液进行快速分解,在硫、磷混合酸的存在下,以二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液直接滴定待测溶液至其呈现稳定的紫色(三十秒内不褪色),即为到达滴定终点,最后通过计算可得到氧化亚铁含量。反应表达式如下:
为了防止在分解过程中待测试样中的亚铁离子被氧化,可先向待测试样中加入近沸的硫酸,再加入氢氟酸,然后迅速将其加热至沸腾状态,利用溶解试样时产生的大量混合酸蒸汽来防止氧化亚铁被进一步氧化,避免增大测定误差。并通过加入饱和硼酸除去剩余的氟离子对滴定过程的干扰。
硫酸亚铁铵间接滴定法
该方法首先在待测试样中加入一定量的偏钒酸铵,然后,在室温条件下用氢氟酸浸取分解试样,此时,被溶解的亚铁离子被偏钒酸铵[ǎn]氧化为三价铁离子
再用硫酸亚铁铵标准溶液返滴定剩余的偏钒酸铵溶液,依据滴定等量偏钒酸铵消耗的硫酸亚铁铵标准溶液量与滴定剩余的偏钒酸铵消耗的硫酸亚铁铵标准溶液量之差,即可计算得到氧化亚铁含量。
在滴定前,可通过加入硼酸,使其通过生成氟硼酸来掩蔽氟离子,来防止氟离子干扰滴定反应,造成测量误差。
应用领域
编辑氧化亚铁常被用作催化剂、瓷坯及瓷釉的着色剂、制备含铁催化剂的原料、制备亚铁盐的原料、以及用于制造玻璃、搪瓷、炼钢和霓虹灯的电极发射层等。此外,氧化亚铁还常与三氧化二铁及其他矿物颜料相结合使用。
安全事宜
编辑毒性
研究数据表明,氧化亚铁不属于人类致癌物,其人体吸入的最高容许浓度TLV-TWA(以可吸入粉尘计,8小时时间加权平均值)为5 mg/m³ 。偏移限制建议:在一个工作日内,人体吸入氧化亚铁的总含量不超过平均阈值(TLV-TWA)的前提下,人体吸入氧化亚铁的暴露水平的偏差不得超过TLV-TWA的3倍,总共不超过30分钟,并且在任何情况下都不应超过TLV-TWA的5倍。以鼠为实验对象,其口服氧化亚铁的LD₅₀(半数致死量)毒性数值>15 g/kg。
健康危害
氧化亚铁燃烧时会产生具有刺激性和腐蚀性的有毒气体,人体吸入后会对肺部和胃肠道产生严重刺激 ,甚至导致患上铁尘肺。此外,空气中的氧化亚铁颗粒在分散时可以迅速达到有害浓度,特别是如果粉末状,则其达到有害浓度的速度更快。因此,长期或反复接触氧化亚铁,可能会导致人体裸露在外的皮肤和眼睛受到严重灼伤。
防护措施
使用氧化亚铁期间禁止吃东西、饮水和吸烟,操作结束后后应及时清洗手和脸。吸入防护:20℃时,氧化亚铁的蒸发可忽略不计,但容易扩散,尤其是为粉末状的氧化亚铁可较快地达到空气中颗粒物有害浓度,因此,应当注意防止粉尘扩散,避免吸入细微颗粒和雾气,使用局部排气或呼吸保护装置;手部防护:佩戴防护手套;皮肤防护:在没有火灾危险的情况下,应当穿着特定的化学防护服;眼部防护:佩戴安全护目镜。
急救措施
当因吸入氧化亚铁引发中毒时,应当立即将患者转移至空气流通处,评估患者的呼吸功能和脉搏,确保患者呼吸没有受阻。当患者呼吸急促或呼吸困难时,要立即进行吸氧;当患者呼吸停止时,要立即进行人工呼吸。并始终安抚患者情绪,使其尽量保持冷静和身体感到温暖,立即送医治疗;当因摄入氧化亚铁引发中毒时,应立即让患者用清水进行漱口,如果患者可以吞咽,有强烈的咽反射,并且不流口水,可给予患者5-200毫升/公斤的水进行稀释,安抚患者情绪,使其尽量保持冷静和身体感到温暖,并立即送医治疗;当氧化亚铁进入眼睛时,应立即用大量流动清水冲洗眼睛(允许情况下,可小心摘除隐形眼镜)至少二十分钟,安抚患者情绪,使其尽量保持冷静和身体感到温暖,并立即送医治疗,在就医过程中连续使用生理盐水冲洗眼睛;当皮肤直接接触氧化亚铁导致烧伤时,首先将受伤者身上被污染的衣服和鞋子脱下,用大量流动清水冲洗皮肤,安抚患者情绪,使其尽量保持冷静和身体感到温暖,并立即送医治疗。
火灾风险
氧化亚铁不溶于水,但在高温时与水接触时可能会导致其与水发生剧烈或爆炸性反应。氧化亚铁与潮湿空气或湿气接触可能会被点燃,导致其迅速燃烧。当氧化亚铁被加热至一定温度或卷入火灾时可能会导致其发生爆炸性分解。灭火后也可能重新被点燃。装有氧化亚铁的容器在加热时可能会发生爆炸。
消防措施
当火灾发生时,请勿直接向氧化亚铁上喷洒水或二氧化碳,避免其与水或二氧化碳接触发生反应,从而引发更大危险。如果氧化亚铁周围发生火灾,所有类型灭火剂均可使用。并且,可在保证安全的前提下将未损坏的容器从火灾区域移开。如果坦克、轨道车或油罐车卷入火灾,应当向各个方向隔离 800 米(1/2 英里),并考虑向各个方向初步疏散800 米(1/2 英里),始终从最远距离处开始灭火。此外,用大量水冷却涉及容器,直至熄灭,并注意勿将水引向泄漏源或安全装置,始终远离被火吞没的坦克、轨道车等设施。
储存运输
氧化亚铁暴露于空气中,极易被空气中的氧气氧化变质,或因吸收二氧化碳而变质,因此,需将其贮存在隔绝空气的密闭环境内。由于,氧化亚铁可溶于酸生成亚铁盐,因此,在贮存和运输过程中应避免与酸性物质接触,避免氧化亚铁变质。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/1238364/
